Die Welt der Zoonoseerreger ist vielfältig
Zoonosen sind Erkrankungen, die zwischen Mensch und Tier übertragbar sind. Damit hören die Gemeinsamkeiten jedoch auch schon wieder auf. Näher betrachtet ist die Gruppe der Zoonosen sehr vielfältig. Das beginnt bereits bei der Art des Krankheitserregers, welcher zu den Viren, Bakterien, Pilzen, Parasiten oder Prionen zählen kann. Aber auch die Art der Übertragung – ob direkt, über einen Vektor (wie z. B. Stechmücken oder Zecken) oder über tierische Lebensmittel – kann sehr unterschiedlich aussehen. Weltweit sind mehr als 200 Zoonosen bekannt.
Monatliche Steckbriefe – Zoonosen im Fokus
Mit unserer Rubrik „Zoonose des Monats“ möchten wir Ihnen einen kleinen Einblick in die vielfältige und spannende Zoonosenforschung innerhalb der Nationalen Forschungsplattform für Zoonosen geben. Hierzu stellen wir Ihnen jeden Monat einen Zoonoseerreger in einem gemeinsam mit Experten aus unser Community erstellten „Erregersteckbrief“ vor. Denn auch abseits von Grippe- und Coronaviren gibt es in der Welt viele erwähnenswerte Erreger. Genug um die Rubrik für die nächsten 17 Jahre mit Inhalt füllen zu können. Also viel Spaß beim Lesen!
April 2021 - MRSA
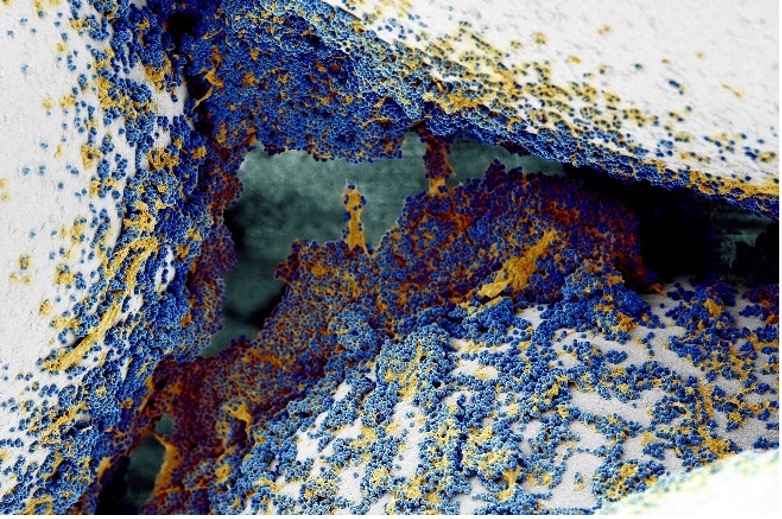
Kolorierte Biofilm-bildende MRSA. Die kugelförmigen Bakterien (blau) siedeln auf Oberflächen (weiß) und bilden dabei durch Ablagerung von extrazellulärem Material (gelb) einen Biofilm. Quelle: C. Schaudinn/Koloration: C. Jahnke/ZBS-4/RKI (Raster-elektronenmikroskopie)
|
Beschreibung |
|
|
|
|
Erstmals entdeckt |
|
|
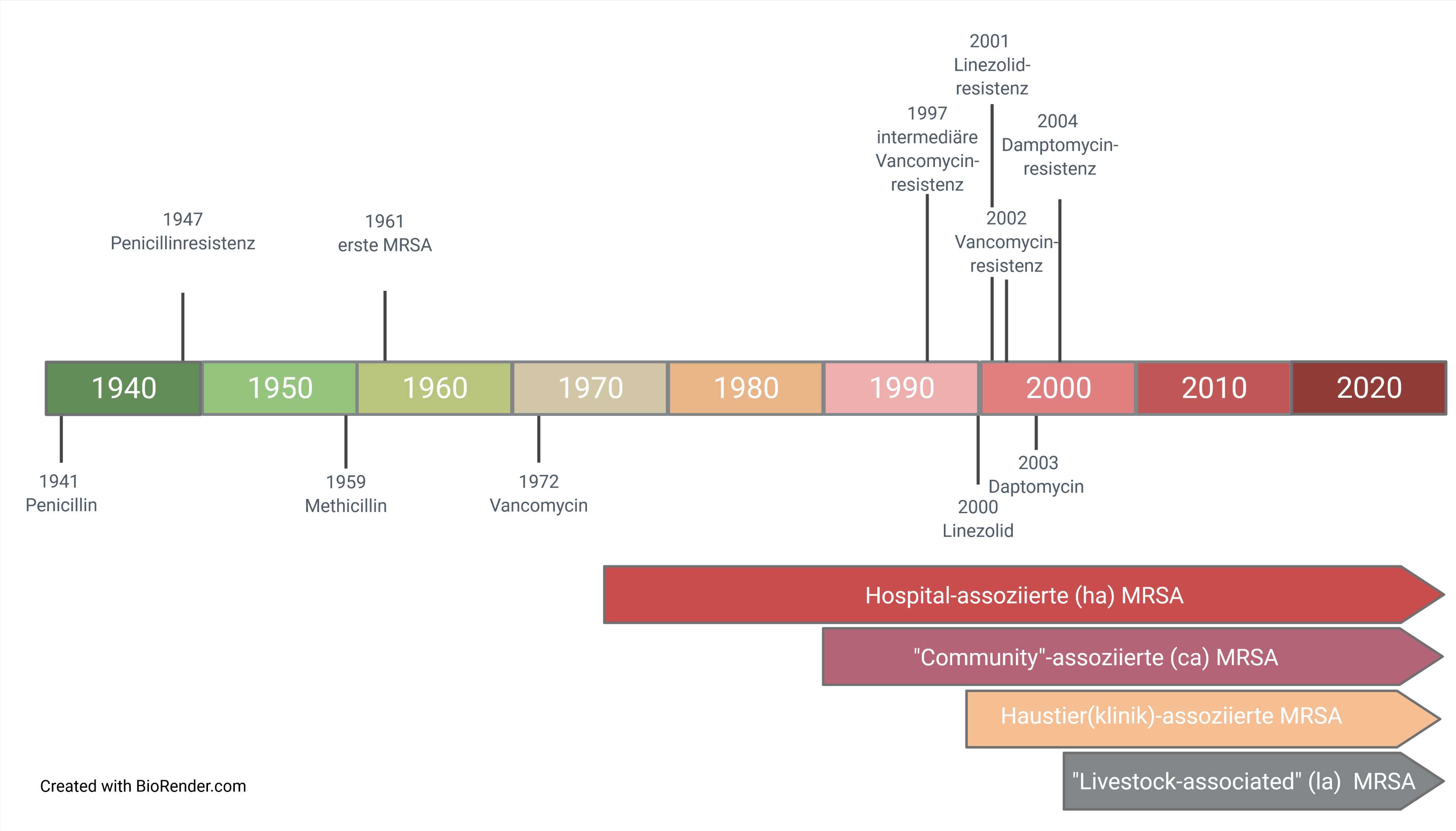
Die ersten MRSA wurden bereits kurz nach der Einführung von Methicillin als Antibiotikum in England beschrieben (Abbildung 2). Ab den 1980er Jahren sorgte das Auftreten von MRSA in der Humanmedizin für Besorgnis, insbesondere da diese Antibiotika-resistenten Bakterien sich in Krankenhäusern („hospital-associated“ MRSA, ha-MRSA) verbreiteten und zu einer Vielzahl von schweren Infektionen und Todesfällen führten. Während um 1990 in Deutschland noch >95% der S. aureus Bakterien, die Infektionen bei Menschen verursachten, empfindlich für Methicillin waren, stieg der Anteil der unempfindlichen Bakterien bis 2005 auf ca. 25% an. Vorranging geschah die Verbreitung einzelner MRSA-Klone in Krankenhäusern und Pflegeeinrichtungen; MRSA-Infektionen in der Allgemeinbevölkerung blieben in Deutschland selten („community-assocciated“ (ca) MRSA). Durch die Einführung und konsequente Umsetzung besonderer Hygienemaßnahmen nahm dieser Anteil im letzten Jahrzehnt stetig ab und liegt in Deutschland aktuell bei <10%. Um Infektionen durch MRSA auch dauerhaft weiter senken zu können, müssen die präventiven Maßnahmen weiter fortgesetzt und intensiviert werden.
Abb. 2: Einführung von Antibiotika für die Behandlung von Erkrankungen durch S. aureus, Nachweis von Resistenzen und Ausbreitung bei Menschen und Tieren. In den 1990er Jahren gab es erste Publikationen zu MRSA bei Tieren, zunächst bei Haustieren wie Pferden und Hunden. Ab Mitte der 2000er Jahre traten MRSA auch bei Nutztieren auf, insbesondere bei Schweinen, die besonderen klonalen Linien zugehörig sind („livestock-associated (la)). Von medizinischer Bedeutung war, dass diese Tier-assoziierten MRSA-Stämme auf Personen mit beruflichem Kontakt zum Nutzvieh und deren Angehörige übertragen werden konnten. Hiervon ausgehend wurden diese MRSA vornehmlich in Gebieten mit hoher Schweinehaltung in die regionalen Krankenhäuser eingetragen. Zahlreiche weitere Studien zeigten dann das weltweite Auftreten dieser und anderer MRSA bei Nutztieren (Rinder, Schweine und Geflügel), bei Landwirten und später auch auf Fleisch. Parallel dazu gab es in klinischen Einrichtungen für Kleintiere und Pferde immer wieder MRSA-Ausbrüche. In einer deutschlandweiten Studie, die 2014 publiziert wurde, waren mehr als 50% der in Wundabstrichen von Hunden, Katzen und Pferden nachgewiesenen S. aureus MRSA. Analog zur Epidemiologie in der Humanmedizin sind hier die nasale Kolonisation der Tierärzte und Mitarbeiter, die Aufnahme von bereits mit MRSA kolonisierten oder infizierten Tieren sowie hygienische Mängel entscheidende Einflussgrößen auf die lokale Situation. |
|
|
Wo kommt der Erreger vor? |
|
|
MRSA werden bei Menschen und Tieren (vorwiegend Nutz- und Begleittiere, seltener Wildtiere) sowie auf den von ihnen kontaminierten Oberflächen nachgewiesen. Das European Centre for Disease Prevention and Control (ECDC) schätzte, dass im Jahr 2015 mehr als 148.000 Menschen in der EU eine MRSA-Infektion erlitten haben, an der mehr als 7.000 Menschen gestorben sind. Insgesamt ist der Nachweis einer durch MRSA verursachten invasiven Infektion in Süd- und Südost-Europa um ein Vielfaches häufiger als beispielsweise in skandinavischen Ländern und den Niederlanden. Während in Deutschland der Anteil MRSA an allen S. aureus aus Blutkulturen von 20,8% im Jahr 2010 auf 7,6% im Jahr 2018 gesunken ist (EARS-Net), zeigen andere Europäische Länder wie Italien oder Griechenland diesen Trend nicht. Von allen schweren MRSA-Blutstrominfektionen waren 2018 3% solche, die durch typische la-MRSA verursacht werden (RKI). Dieser Anteil lag in den Nutztierhaltungsregionen in NRW und Niedersachsen bei >10%. |
|
|
Betroffene Tierspezies, Reservoir |
|
|
Betroffen sind vor allem der Mensch als Hauptwirt sowie Säugetiere mit Menschenkontakt. Als Reservoir für MRSA gelten vor allem besiedelte Menschen in Krankenhäusern und Tiere in Tierkliniken sowie die Massentierhaltung und Fleischproduktion. |
|
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
|
Eine alleinige Besiedlung, beispielsweise der Nase, mit MRSA, ist keine Erkrankung. Eine Besiedlung kann jedoch das Risiko für eine Infektionskrankheit durch MRSA erhöhen. Als Risikofaktoren für eine solche Besiedlung gelten frühere Aufenthalte in Krankenhäusern (bei Tieren analog) und die vorherige Gabe von Antibiotika, vor allem für Menschen auch weitere Faktoren, wie Multimorbidität, das Vorhandensein chronischer Wunden, Diabetes mellitus, Dialysepflichtigkeit und Aufenthalt in Pflegeeinrichtungen. Menschen mit Kontakt zu Nutztieren wie Schweine, Rinder oder auch Geflügel wie Tierärzte oder Landwirte sind häufiger mit MRSA besiedelt als die allgemeine Bevölkerung. |
|
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
|
MRSA können alle S. aureus-typischen Infektionen verursachen. Am häufigsten treten bei Menschen und Tieren eitrige Haut- und Weichgewebeinfektionen auf, z.B. Abszesse, die durch chirurgische Maßnahmen (Spaltung) und Antibiotika behandelt werden können. Besonders schwere Infektionen entstehen, wenn MRSA die Haut- und Schleimhautbarrieren überwinden und in das Gewebe und/oder die Blutbahn gelangen. Dann infizieren sie z.B. die Herzklappen, das Lungengewebe oder Knochen und Gelenke, führen dort zu eitrigen Entzündungen und nachfolgend zu Zerstörungen von Geweben und Organen sowie zur Sepsis. Über Blut- und Lymphgefäße oder entlang von anatomischen Strukturen kann es zu weiteren Absiedlungen und Abszessen in den verschiedensten Organen (z.B. Hirnabszesse) kommen. Tückisch sind diese Infektionen auch, weil S. aureus einschließlich MRSA besonders gut darin sind, sich an natürliche und künstliche (z.B. Katheter, künstliche Gelenke) Oberflächen anzuheften und sogenannte Biofilme zu bilden, die durch Antibiotika nur schwer oder nicht therapierbar sind. |
|
|
Gibt es Medikamente oder einen Impfstoff? |
|
|
Hier muss unterschieden werden, ob eine MRSA-Kolonisation i.d.R. im Vorfeld einer geplanten Operation versucht werden soll zu beseitigen oder ob eine MRSA-Infektion therapiert werden muss. Zur Senkung des Infektionsrisikos ist der Versuch der Beseitigung einer MRSA-Besiedlung der Nase angezeigt. Zusätzlich zur Anwendung desinfizierender Seifen oder Lösungen wird sehr häufig ein spezielles Antibiotikum, Mupirocin, verwendet, das als Nasensalbe appliziert wird. Wenn Patienten eine MRSA-bedingte Infektionskrankheit erleiden, gibt es derzeit noch eine Anzahl verschiedener Antibiotika, die trotz der Multiresistenz vieler MRSA wirksam sein können (z.B. Vancomycin, Linezolid, Daptomycin). Zu bedenken ist jedoch, dass diese Antibiotika z.T. klinisch weniger wirksam sein können, weil sie sich z.B. nicht so gut im infizierten Gewebe (Knochen, Lungengewebe) verteilen können oder andere ungünstige Eigenschaften haben. Schwierig wird es, wenn Tiere mit MRSA kolonisiert oder infiziert sind. Da viele Wirkstoffe keine Zulassung für die Anwendung beim Tier haben, ist es für Tierärzte oft schwer, Infektionen wirksam zu therapieren. Auch die Dekolonisierung von Tieren ist nicht trivial. Impfstoffe gegen S. aureus bzw. MRSA sind nicht verfügbar; bisherige Entwicklungen waren nicht erfolgreich. |
|
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
|
MRSA-Screeningprogramme, oft im Rahmen regionaler Netzwerke, gehören zusammen mit anderen Maßnahmen heute zum unerlässlichen Repertoire einer guten Infektionsvorbeugung an human- und veterinärmedizinischen Einrichtungen. In Deutschland müssen Infektionen im Krankenhaus durch MRSA nach §23 des Infektionsschutzgesetzes (IfSG) erfasst werden. Daten des Nationalen Surveillancesystems MRSA-KISS zeigen, dass 2019 etwa 6 von 1.000 im Krankenhaus behandelte Patienten MRSA-Träger waren. Zudem gibt es eine Meldepflicht für MRSA aus Blutkulturen nach §7 IfSG, wodurch 2020 1.126 Nachweise (RKI SurvStat) dokumentiert wurden. Mit ARS, der Antibiotika-Resistenz-Surveillance in Deutschland - wurde die Infrastruktur für eine flächendeckende Surveillance der Antibiotika-Resistenz insgesamt etabliert, die sowohl die stationäre Krankenversorgung als auch den Sektor der ambulanten Versorgung abdeckt, so dass belastbare Daten zur Epidemiologie der Antibiotika-Resistenz in Deutschland bereitgestellt werden. Auf Basis dieser verlässlichen und repräsentativen Daten können gezielt Maßnahmen zur Begrenzung des Problems ergriffen werden. Das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) erhebt jährlich Resistenzdaten zu Infektionserregern von Lebensmittel liefernden Tieren und Heimtieren (Resistenzmonitoring GERM-Vet). Hierbei wird auch das Auftreten von MRSA bei den unterschiedlichen Tierarten erfasst. Im Rahmen des Zoonosenmonitorings werden repräsentative Proben aus der Lebensmittelkette (Erzeugerbetrieben, Schlachthöfen, Einzelhandel) und aus der „freien Wildbahn“ auf MRSA untersucht. Das Nationales Referenzlabor für koagulasepositive Staphylokokkeneinschließlich Staphylococcus aureus am Bundesinstitut für Risikobewertung (BfR) ist zuständig für Fragen zur Lebensmittelsicherheit und Lebensmittelhygiene im Hinblick auf MRSA in Lebensmitteln. Das Referenzlabor für MRSA in der Humanmedizin ist das Nationale Referenzzentrum (NRZ) für Staphylokokken und Enterokokken am Robert Koch-Institut. Für infektionsmedizinische Probleme durch MRSA bei Haustieren oder in Tierkliniken gibt es das Konsiliarlabor der Deutschen Veterinärmedizinischen Gesellschaft (DVG) für Methicillin-resistente Staphylokokken an der Freien Universität Berlin (Institut für Mikrobiologie und Tierseuchen). |
|
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
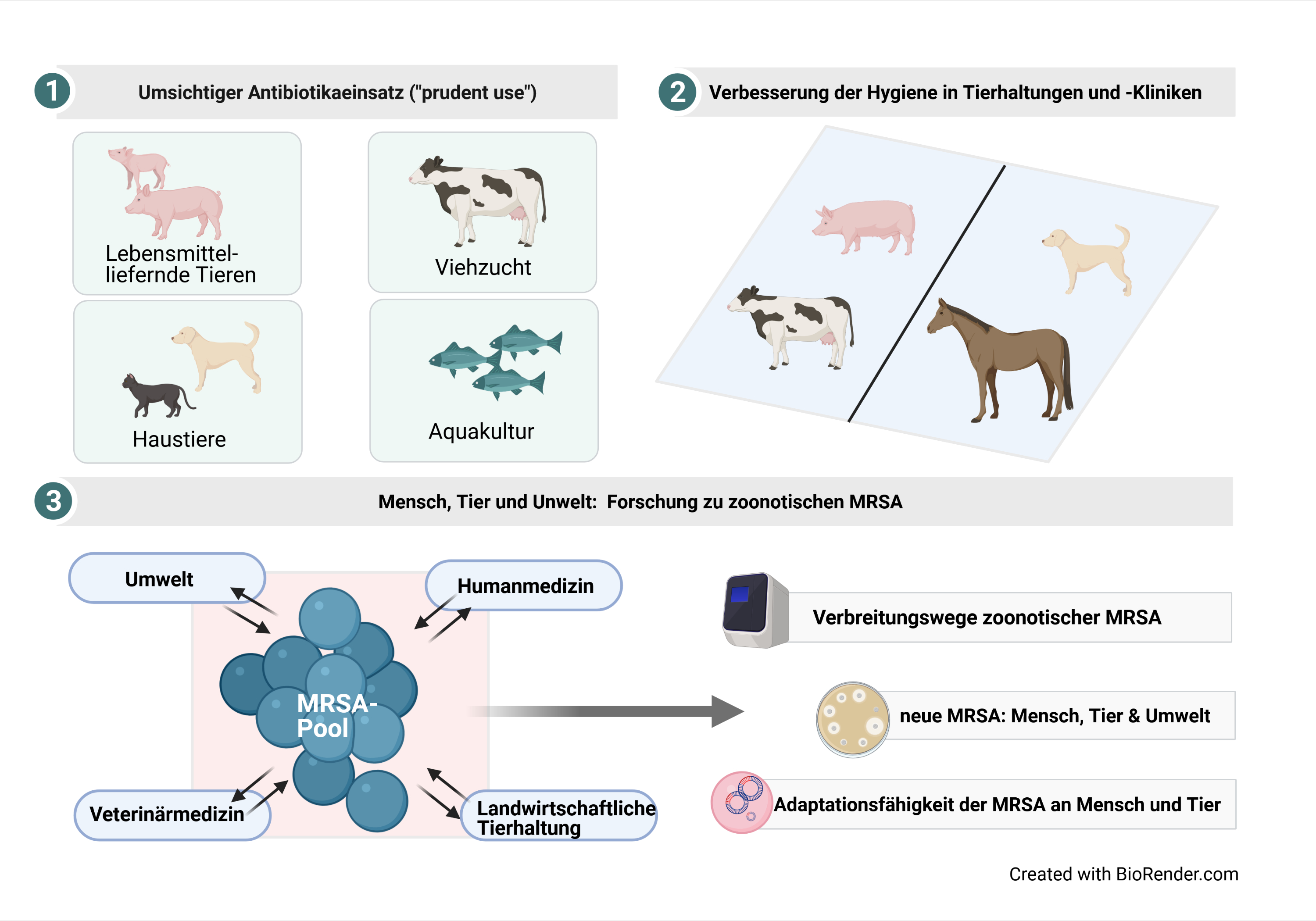
Die Forschung zum Thema zoonotische MRSA verfolgt einen transsektorialen und interdisziplinären Ansatz: Aufgrund der erforderlichen engen Kooperation zwischen Wissenschaftler*innen aus der Human- und Veterinärmedizin sowie den Agrar- und Umweltwissenschaften ist hier der „One Health“- Gedanke zunehmend Richtschnur, denn Antibiotikaresistenzen kennen keine menschengemachten organisatorischen und fachlichen Grenzen (Abbildung 2, 3). |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
|
Für die Bekämpfung zoonotischer MRSA gibt es grundsätzlich zwei sich ergänzende Hauptaspekte, a) die Verringerung der MRSA-Last bei Haus- und Nutztieren sowie b) die Verhinderung der Übertragung von MRSA zwischen Menschen und Tieren in beide Richtungen (Abbildung 3).
Abb. 3: Aktuelle Forschung auf dem Gebiet „Interventionen gegen zoonotische MRSA“ |
|
|
Wo liegen zukünftige Herausforderungen? |
|
|
Die Herausforderungen für die zukünftige Forschung sind, analog zur Komplexität der beteiligten Faktoren (Human- und Tiermedizin, Landwirtschaft und Umwelt), sehr vielfältig: Eine Beteiligung aller betroffenen Gebiete sowie länderübergreifender Kooperationen zur Verringerung der weiteren weltweiten Akkumulation von Antibiotikaresistenzen angesichts der wenigen neuen (oral applizierbaren) Wirkstoffe zur Behandlung von Infektionskrankheiten ist notwendig. Die Forschungen betreffen MRSA, aber auch andere multiresistente Erreger (MRE). Wichtige Stichpunkte sind:
|
|
|
Sonstiges |
|
|
Weiterführende Informationen Forschungsverbund #1HealthPREVENT und aktuelle Publikationen des Verbundes Nationale Referenzzentrum (NRZ) für Staphylokokken und Enterokokken am Robert Koch-Institut Nationales Referenzzentrum für Surveillance von nosokomialen Infektionen (MRSA-KISS) Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) Antibiotika-Resistenz-Surveillance in Deutschland (ARS) Bundesinstitut für Risikobewertung (BFR): Fragen und Antworten für Tierärzte zu MRSA Bundeszentrale für gesundheitliche Aufklärung (BZgA): Informationen zu MRSA Nationale Kampagne zur Verbesserung der Compliance der Händedesinfektion in deutschen Gesundheitseinrichtungen (Aktion saubere Hände) Informationsseite der World Health Organization (WHO) zu antimikrobieller Resistenz Informationen und Guidelines zur Prävention und Kontrolle von MRSA (Robert Koch-Institut) Nationales Referenzlabor für koagulasepositive Staphylokokken einschließlich Staphylococcus aureus (NRL-Staph) |
Dr. Birgit Walther (Robert Koch-Institut), Dr. Antina Lübke-Becker (Freie Universität Berlin), Dr. Christiane Cuny (Robert Koch-Institut), Prof. Dr. Karsten Becker (Universitätsmedizin Greifswald, Friedrich Loeffler-Institut), Dr. Robin Köck (Universitätsklinikum Münster, DRK Kliniken Berlin)
März 2021 - Brucella spp.
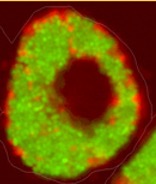
Fluoreszenzmikroskopisches Bild intramakrophagischer Brucella suis (GFP markiert). Brucella-enthaltende Vakuolen füllen das Zytosol der Wirtszelle nahezu vollständig aus. (Bild: Stephan Köhler, Institut de Recherche en Infectiologie à Montpellier (IRIM), CNRS, INSERM, Frankreich)
|
Beschreibung |
|
Brucella spp. gehören zu den Alphaproteobacteria und sind damit nah verwandt mit Tier- und Pflanzenpathogenen, wie Bartonella spp. und Agrobacterium tumefaciens, sowie Umweltkeimen, wie beispielsweise Ochrobactrum spp. Innerhalb des Genus werden aktuell zwölf Spezies beschrieben, welche sich in ihrer Pathogenität und ihrem tierischen Hauptwirt unterscheiden (siehe betroffene Tierspezies). Es handelt sich um fakultativ intrazelluläre, gramnegative, kokkoide Stäbchenbakterien. Die Unterscheidung der einzelnen Spezies und einiger Biovare beruht auf einer Reihe klassischer mikrobiologischer Tests (CO2-Bedarf, H2S-Bildung, Ureaseaktivität, Wachstumshemmung durch die Farbstoffe Thionin und Fuchsin, Agglutinationstests mit monospezifischen Antikörpern, Phagenlyse). Brucellen galten bislang als obligat aerob und unbeweglich. Sie sind aber in der Lage, ihren Stoffwechsel unter Sauerstoffmangel auf Nitratatmung umzustellen. Neuere atypische Brucella-Spezies, welche aus wechselwarmen Tieren isoliert wurden, besitzen außerdem ein Flagellum, welches ihnen die Fortbewegung ermöglicht. Sie gelten als Vorgänger der klassischen humanpathogenen Spezies. Ein Lipopolysaccharid an der Zelloberfläche ermöglicht Brucellen das Eindringen in Zellen des Monozyten-Makrophagen-Systems des Wirts und verhindert die Verschmelzung des Phagosoms mit dem Lysosom. Das saure Milieu innerhalb des Phagosoms aktiviert einen VirB Typ IV-Sekretionsapparat des Bakteriums, über den Effektorproteine in die Zielzelle ausgeschleust werden, welche die Assoziation der Brucella-enthaltenden Vakuole mit dem endoplasmatischen Retikulum vermitteln und den Umbau zu einer erregerspezifischen replikativen Nische fördern. Die Infektion des Makrophagen verhindert dessen Apoptose, so dass das Pathogen sein eigenes intrazelluläres Überleben sichert und sich ungestört in der Zielzelle vermehren kann. Einige Brucella Spezies werden der Risikogruppe 3 zugeordnet. Brucella suis wurde in den 1950er Jahren erstmals als biologischer Kampfstoff in den Vereinigten Staaten aufmunitioniert. Brucella zählt zur Kategorie B der bioterroristisch relevanten Agenzien mit mittlerer Letalitätsrate, ist sehr umweltstabil, hoch infektiös und lässt sich leicht als Aerosol ausbringen. Andererseits kann die Verbreitung des Erregers aber auch gut eingedämmt werden und die humane Brucellose ist behandelbar. |
|
Erstmals entdeckt |
|
Der Erreger wurde erstmals im Jahr 1887 von Dr. David Bruce, einem Militärarzt, aus der Milz eines verstorbenen Soldaten des britischen Empire isoliert und als Micrococcus melitensis beschrieben. Bruce war im Dienst der britischen Krone auf Malta und diagnostizierte bei zahlreichen, der dort stationierten Soldaten, ein unklares Fieber. Die Krankheit, welche damals auch als Mittelmeer- oder Maltafieber bekannt war, führte bei den erkrankten Soldaten zu langanhaltender Dienstunfähigkeit und ca. 10 % der Infizierten verstarben. Knapp ein Jahrzehnt nach der Erstbeschreibung des Bakteriums gelang es dem Malteser Arzt Dr. Themistocles (aliasTemi) Zammit im Jahr 1905, den Übertragungsweg der Brucellose aufzuklären. Er isolierte den Erreger aus Ziegenmilch, welche üblicherweise direkt nach dem Melken als noch euterwarme Rohmilch verzehrt wurde. Ein angeordnetes Konsumverbot führte letztlich zu einem Rückgang der Krankheitszahlen bei den auf Malta stationierten britische Soldaten. |
|
Wo kommt der Erreger vor? |
|
Brucella spp. sind weltweit verbreitet. Etwa 500.000 Humaninfektionen werden jährlich gemeldet; die Dunkelziffer wird zwanzigmal höher angenommen. Infektionen mit Brucella melitensis und abortus werden gehäuft aus dem Mittelmeerraum, der Balkanregion, dem Mittleren Osten, Asien, Afrika, Mittel- und Südamerika berichtet. In Deutschland, Nordeuropa und Nordamerika wurde die Schaf-/Ziegen- und Rinderbrucellose erfolgreich aus den Nutztierbeständen eradiziert. Es gibt zahlreiche Länder und Regionen, in denen scheinbar nur eine geringe Prävalenz der Brucellose in den Nutztierbeständen vorliegt. Allerdings sind nicht überall hinreichend gute Überwachungs- und Kontrollsysteme für Zoonosen etabliert. Auch in eigentlich brucellosefreien Gebieten kann es sporadisch zu Ausbrüchen infolge eines Überspringens des Erregers aus der Wildtierpopulation kommen. In Deutschland beispielsweise sind immer wieder Schweinezucht- und Mastbetriebe mit Freilandtierhaltung betroffen. Die Hausschweine infizieren sich bei Wildschweinen mit B. suis bv 2, ein Biovar von geringer Humanpathogenität. |
|
Betroffene Tierspezies, Reservoir |
|
Mehr als ein Jahrhundert lang galten lediglich Säugetiere als mögliche Wirte der Brucella spp. Die verschiedenen Spezies zeigen eine ausgesprochene Wirtspräferenz. Brucella melitensis (bv 1-3) infiziert überwiegend Schafe, Ziegen und Kamele, B. abortus (bv 1-7, 9) Rinder und Büffel, B. suis in Abhängigkeit vom Biovar Schweine (bv 1-3), Rentiere (bv 4) und Nagetiere (bv 5), B. canis Hunde, B. ovis Schafe und B. neotomae die Wüstenbuschratte. Von diesen sechs klassischen Spezies gelten die drei Erstgenannten als besonders humanpathogen, während B. canisseltener zur Infektion des Menschen führt und B. neotomae nur in Einzelfällen. Aus Meeressäugetieren wurden B. ceti (Wale, Tümmler und Delfine) und B. pinnipedialis (Seehunde, Seelöwen, Walrösser) isoliert. Ausschließlich der Sequenztyp ST27 bei B. ceti gilt unter den marinen Brucellae als humanpathogen. Die neuen und teilweise atypischen Brucella spp. umfassen B. microti (in Feldmäusen vorkommend), B. vulpis (in Füchsen) und B. papionis (in Pavianen). Brucella inopinata und ähnliche Stämme wurden anfangs im Zusammenhang mit opportunistischen Infektionen beim Menschen beschrieben. Zunehmend kommt es zum Nachweis dieses Erregers und B. microti-ähnlicher Stämme bei Amphibien, z.B. bei Afrikanischen Ochsenfröschen, Laub- und Seefröschen. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Menschen infizieren sich meist infolge des Verzehrs kontaminierter tierischer Lebensmittel. Rohmilch und nicht-pasteurisierte Milchprodukte, wie Rohmilchkäse, aber auch rohes Fleisch können zur Infektion führen. In endemischen Gebieten mit hoher Prävalenz der Brucellose in den Nutztierbeständen treten auch zahlreiche Fälle durch direkten Kontakt mit infizierten Tieren bzw. mit hochkontagiösem Abortmaterial auf. Dieser Übertragungsweg findet sich in der Regel bei Berufsgruppen, welche vermehrt Tierkontakte haben oder tierische Produkte verarbeiten, z.B. bei Veterinären*Innen oder Schlachthofpersonal. In brucellosefreien Ländern sind die meisten Fälle auf Reisen in Endemiegebiete oder Migration aus denselben zurückzuführen. In Deutschland sind überwiegend Menschen mit türkischem Migrationshintergrund betroffen. Außerdem ist die Brucellose die häufigste bakterielle Laborinfektion weltweit, da einzelne Bakterien ausreichen, um nach einer Inhalation zum vollen Krankheitsbild zu führen. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Die Brucellose vermindert bei Haus- und Nutztieren die Reproduktionsrate infolge eingeschränkter Fertilität (ursächlich sind Orchitis und Epididymitis bzw. Endometritis) und durch Spätaborte, Frühgeburten oder die Geburt lebensschwacher Tiere. Häufig verläuft die Infektion aber auch latent, vor allem bei Wildtieren. Beim Menschen präsentiert sich die akute Brucellose als fieberhafter, grippeähnlicher Infekt mit Kopf- und Gliederschmerzen, Abgeschlagenheit und Müdigkeit. Leber, Milz und Lymphknoten sind teilweise vergrößert. Die Fieberkurve kann charakteristischerweise wellenförmig verlaufen mit ansteigender Körpertemperatur über den Tag und einer starken Entfieberung mit ausgeprägter Schweißneigung und Schüttelfrost im Verlauf der Nacht (daher rührt auch die frühere Bezeichnung undulierendes Fieber). Etwa 10-15 % der Patienten entwickeln trotz adäquater antibiotischer Therapie nach sechs Wochen eine chronische Verlaufsform mit sehr unterschiedlichen klinischen Manifestationen. Am häufigsten treten Entzündungen im Bereich des Achsenskeletts (Spondylitis, Sakroiliitis) auf, aber auch periphere Gelenke können betroffen sein. Verantwortlich für tödliche Verläufe (ca. 2 % aller Fälle) sind Meningoenzephalitis und Endokarditis. Die Klinik der chronischen Brucellose ist sehr variabel und die Infektion kann nahezu jedes Organsystem befallen. In betroffenen Geweben kommt es zu einer granulomatösen, nicht-verkäsenden Entzündungsreaktion, selten mit Abszessbildung. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Für Nutztiere stehen Impfstoffe zur Verfügung. Zum einen der B. melitensis-Stamm Rev 1 für Schafe und Ziegen und zum anderen die beiden B. abortus-Stämme S19 und RB51 für Rinder. Es handelt sich um attenuierte Lebendimpfstoffe, welche allerdings nach der Impfung ebenfalls zu Aborten führen können und beim Menschen das Vollbild der Erkrankung auslösen. Insbesondere der Einsatz von RB51 wird in diesem Zusammenhang kritisch diskutiert. Ein geimpftes Tier lässt sich aufgrund einer anderen LPS-Struktur (rough LPS) beim RB51-Impfstamm leicht serologisch von einem mit einem Wildstamm (smooth LPS) infizierten Tier unterscheiden, was ein Vorteil in der Überwachung darstellt. Andererseits besitzt der Impfstamm eine Antibiotikaresistenz gegenüber Rifampicin, welches als Mittel der ersten Wahl in der antibiotischen Therapie der humanen Brucellose eingesetzt wird. Nur in Regionen mit einer sehr hohen Prävalenz der Brucellose in Nutztierbeständen macht die Impfung der Tiere letztlich Sinn, um die Verbreitung des Erregers einzudämmen. Impfstoffe für die Anwendung beim Menschen (beispielsweise für stark exponierte Berufsgruppen) gib es nicht, da Totimpfstoffe oder Bakterienbestandteile keine ausreichend hohe Immunität hervorrufen. Die Postexpositionsprophylaxe entspricht quasi der antibiotischen Therapie einer akuten Brucellose. Für die Behandlung der Brucellose kommen verschiedene Antibiotika zum Einsatz, welche in unterschiedlicher Kombination verabreicht werden. Als First-Line-Therapie wird Rifampicin kombiniert mit Doxycyclin empfohlen. Alternativ kann auch ein Aminoglykosid (Streptomycin, Gentamicin) zusammen mit Doxycyclin verabreicht werden. Das letztgenannte Schema kommt häufiger in Endemiegebieten zum Einsatz, da die Zahl der primären Therapieversager und Rezidive geringer ausfällt als bei der Anwendung von Rifampicin. Im Gegenzug werden potenziell schwerwiegende Nebenwirkungen der Aminoglykoside (Ototoxizität, Nephrotoxizität) in Kauf genommen. Cotrimoxazol (Trimethoprim und Sulfamethoxazol) wird bei Schwangeren als Monotherapie verabreicht und ersetzt bei Kindern bis zum achten Lebensjahr das Doxycyclin (CAVE: Zahnschmelzdefekte und verzögertes Knochenwachstum). Antibiogramme sind für die Therapie der humanen Brucellose nicht wegweisend. Beispielsweise sind Brucella spp. in der in vitro-Testung meist empfindlich gegenüber Ciprofloxacin; das Fluorochinolon wirkt aber nicht im sauren Milieu der intramakrophagischen Brucella-enthaltenden Vakuolen. Die Dauer der Antibiotikatherapie sollte sechs Wochen nicht unterschreiten und muss bei der chronischen Brucellose mit Organmanifestationen in Abhängigkeit vom Behandlungserfolg meist deutlich verlängert werden. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Nach Infektionsschutzgesetz (gemäß § 7 Abs. 1 IfSG) ist der direkte oder indirekte Nachweis von Brucella spp. in Deutschland namentlich meldepflichtig, sofern dieser auf eine akute Infektion beim Menschen hinweist. Die Brucellose der Rinder, Hausschweine, Schafe und Ziegen ist eine anzeigenpflichtige Tierseuche (gemäß § 1 der Verordnung über anzeigepflichtige Tierseuchen). Die Überwachung in den Tierbeständen ist in der Verordnung zum Schutz gegen die Brucellose der Rinder, Schweine, Schafe und Ziegen (Brucellose-Verordnung) geregelt. Sowohl vor dem Import von Nutztieren aus Drittstaaten als auch bei der innergemeinschaftlichen Verbringung innerhalb der Europäischen Union muss zuvor die Brucellosefreiheit des Bestandes garantiert werden. Ein Überwachungssystem für die Brucellose bei Wildtieren existiert nicht. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Schwerpunkte in der aktuellen Forschung zur Brucellose sind:
|
|
Welche Bekämpfungsstrategien gibt es? |
|
In Endemiegebieten kann mit Hilfe von Impfprogrammen bei Rindern, Schafen und Ziegen die Ausscheidung des Erregers und damit die Durchseuchung der Nutztierbestände vermindert werden. Da die Impfung keinen absoluten Schutz darstellt und die Impfstämme selbst infektiös für Tier und Mensch sind, müssen sich effektive Überwachungs- und Kontrollmaßnahmen anschließen. Durch regelmäßige serologische Testungen (Blut oder Tankmilch) oder Verdachtsuntersuchungen bei entsprechenden klinischen Befunden (gehäufte Aborte) werden von der Brucellose betroffene Bestände identifiziert. Positiv getestete Tiere werden vom Bestand abgesondert und infizierte Tiere gekeult. Innerhalb der Europäischen Union erhält der betroffene Tierhalter eine finanzielle Entschädigung. Da diese Strategie in ärmeren Ländern nicht durchzusetzen ist, müssen dort die Verbraucher durch adäquate Maßnahmen der Lebensmittelhygiene geschützt werden. Brucella lässt sich zuverlässig mittels Erhitzens kontaminierter Lebensmittel abtöten und allein das Pasteurisieren von Milch verhindert schon die meisten Infektionen. In Endemiegebieten sind außerdem Arbeitsschutz- und Hygienemaßnahmen im Umgang mit potenziell infizierten Tieren einzuhalten. Dies gilt insbesondere für Berufsgruppen, die in direktem Kontakt mit infizierten Tieren stehen (z.B. im Rahmen der Geburtshilfe) oder tierische Produkte zu Lebensmitteln prozessieren (z.B. in Schlachtbetrieben). |
|
Wo liegen zukünftige Herausforderungen? |
|
Infolge der globalen Warenketten im Tier- und Lebensmittelhandel ist der Wiedereintrag von Brucella spp. in brucellosefreie Nutztierbestände eine der größten Herausforderungen in der weltweiten Kontrolle dieser Zoonose. Auch der Übertrag aus der Wildtierpopulation spielt aufgrund der von Verbrauchern*Innen zunehmend gewünschten artgerechteren Freilandtierhaltung in Industrienationen eine immer größere Rolle. In Endemiegebieten hingegen müssen verbesserte tierärztliche Überwachungs- und Kontrollmaßnahmen etabliert werden. Diese versagen vor allem in Konfliktregionen oder aus Ressourcenmangel. Die Verbraucheraufklärung in ärmeren und ländlichen Regionen müsste deutlich optimiert werden und sollte vor allem das gesundheitliche Risiko beim Verzehr traditioneller Rohprodukte im Fokus haben. Durch vermehrte Migrationsbewegungen und den weltweiten Tourismus werden zukünftig auch viele Brucellose-Patienten in Nicht-Endemiegebieten auftreten. In einer epidemiologischen Studie aus Deutschland konnte belegt werden, dass gerade diese Fälle nur sehr verzögert diagnostiziert und therapiert werden, was chronische und letale Verläufe wahrscheinlicher macht. Deshalb sollte der Brucellose, wie auch anderen derzeit nur wenig beachteten Zoonosen, im Ausbildungscurriculum klinisch tätiger Ärzte mehr Aufmerksamkeit geschenkt werden. |
|
Sonstiges |
|
World Health Organisation (WHO): https://www.who.int/news-room/fact-sheets/detail/brucellosis Centers for Disease Control and Prevention (CDC): https://www.cdc.gov/brucellosis/ Robert Koch-Institut (RKI): https://www.rki.de/DE/Content/InfAZ/B/Brucellose/Brucellose Friedrich-Loeffler-Institut (FLI): https://www.fli.de/de/institute/institut-fuer-bakterielle-infektionen-und-zoonosen-ibiz/referenzlabore/oie-und-nrl-fuer-brucellose/ One Health European Joint Programme - Identification of emerging Brucella species (IDEMBRU): new threats for humans and animals: https://onehealthejp.eu/jrp-idembru/ |
Für die fachliche Unterstützung bei der Erstellung des Brucella spp. Steckbriefes danken wir Prof. Dr. Sascha Al Dahouk (Bundesinstitut für Risikobewertung).
Februar 2021 - Hantaviren
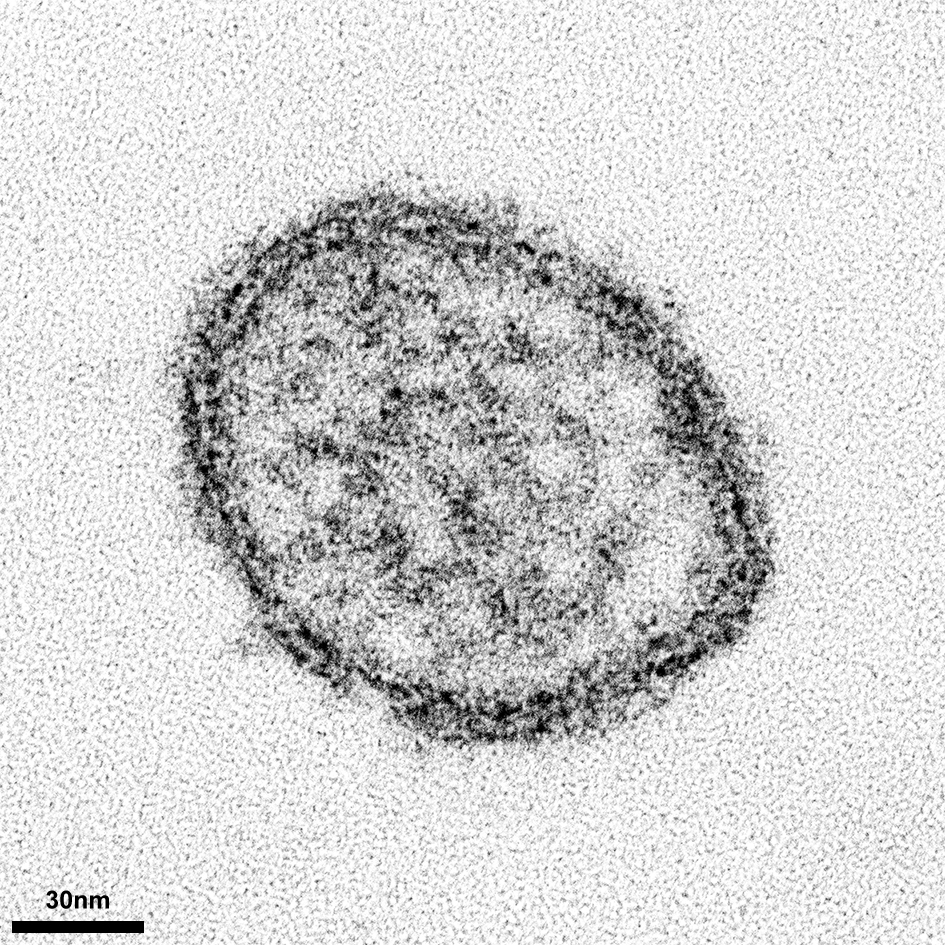
Elektronenmikroskopische Aufnahme eines Hantavirus-Partikels (Copyright Bild: Dr. Kati Franzke, Labor für Elektronenmikroskopie, FLI)
|
Beschreibung |
|
Hantaviren sind behüllte Viren mit einem segmentierten RNA-Genom negativer Polarität. Ordnung Bunyavirales, Familie Hantaviridae, mit 4 Gattungen; die Gattung Orthohantavirus bein-haltet die bisher als humanpathogen bekannten Hantaviren. Die Benennung der Hantaviren erfolgt anhand des Ortes der Erstbeschreibung. |
|
Erstmals entdeckt |
|
Langjährige Untersuchungen nach dem Koreakrieg mit mehreren tausend erkrankten Soldaten führten 1978 zur Entdeckung des Hantaan-Orthohantavirus. Bereits in den 1960er Jahren war das Thottapalayamvirus entdeckt und als Arbovirus klassifiziert worden, das aber erst in den 1990er Jahren nach intensiver genetischer Charakterisierung als Hantavirus identifiziert wurde. |
|
Wo kommt der Erreger vor? |
|
Hantaviren kommen wahrscheinlich weltweit vor; die Datenlage für Australien ist sehr schwach. Das Vorkommen der Erreger ist an das Verbreitungsgebiet der Reservoire gebunden. In Amerika kommen Hantaviren vor, die das Hantavirale Cardiopulmonale Syndrom (HCPS) verursachen mit einer Letalitätsrate von bis zu 40%. In Europa, Asien und Afrika kommen Hantaviren vor, die das Hämorrhagische Fieber mit Renalem Syndrom (HFRS) mit einer Letalitätsrate von bis zu 10% hervorrufen. Das mit Wanderratten und anderen Rattenarten assoziierte Seoul-Orthohantavirus (SEOV), ebenfalls Erreger des HFRS, kommt vermutlich weltweit vor. |
|
Betroffene Tierspezies, Reservoir |
|
Alle bisher als humanpathogen bekannten Hantaviren sind in Nagetieren gefunden worden. Jede Hantavirusart ist in der Regel mit einer Nagetierart assoziiert. Darüber hinaus sind in den vergangenen Jahren weitere Hantaviren in Spitzmäusen, Maulwürfen und Fledermäusen gefunden worden, deren Humanpathogenität unbekannt ist. Außerdem wurden vor kurzem auch Hantaviren bei Fischen und Reptilien entdeckt. Die Reservoirtiere erkranken selber nicht. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Die Hantaviren werden von persistent infizierten Nagetieren mit Urin, Kot und Speichel ausgeschieden. Die Übertragung auf den Menschen erfolgt vorwiegend durch das Inhalieren Virus-kontaminierter Stäube. Ein direkter Kontakt zu den Nagetieren ist für die Übertragung nicht erforderlich. Auch eine Übertragung durch Bisse ist beschrieben worden. Wegen des Expositionsrisikos stellen z.B. Waldarbeiter, Schädlingsbekämpfer und Soldaten besonders gefährdete Risikogruppen dar. Der Umgang mit gelagertem Brennholz, das Reinigen von Schuppen und anderen Räumen oder bestimmte Tätigkeiten im Freien, insbesondere in Jahren mit einer erhöhten Zahl infizierter Nagetiere, können zu einer Gefährdung der Allgemeinbevölkerung führen. |
|
Was für Krankheitssymptome zeigen infizierte Menschen und Tiere? |
|
Der Schweregrad des HFRS-Verlaufs hängt unter anderem von der Art des Hantavirus ab. In Deutschland vorkommende Hantavirus-Arten können grippeähnliche Infektionen mit über drei bis vier Tage anhaltendem hohen Fieber sowie Kopf-, Bauch- und Rückenschmerzen verursachen. In einer darauffolgenden Krankheitsphase können Blutdruckabfall und schließlich Nierenfunktions-störungen bis zum akuten Nierenversagen auftreten. Sehr selten kann sich die Erkrankung auf die Lunge auswirken oder deutlich sichtbare, äußere Blutungen verursachen. Ein großer Teil der Infektionen beim Menschen verläuft jedoch ganz ohne oder mit milden und unspezifischen Symptomen („Sommergrippe“). Bei verschiedenen Nichtreservoirtieren sind Hantavirus-reaktive Antikörper gefunden worden; über Erkrankungen von diesen Tieren ist nichts bekannt. Die Leptospirose stellt eine Erkrankung mit zum Teil ähnlichen Symptomen dar, die auch von Nagetieren auf den Menschen übertragen wird und bei der Differenzialdiagnostik in Betracht gezogen werden sollte. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Bisher existieren in Europa keine zugelassenen Impfstoffe. Die Therapie erfolgt vor allem sympto-matisch. Zum Teil werden Medikamente mit breitem antiviralen Spektrum eingesetzt. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Der Labornachweis von Hantaviren beim Menschen sowie die Erkrankung an virusbedingtem hämorrhagischen Fieber ist laut Infektionsschutzgesetz in Deutschland meldepflichtig. Durch die Meldepflicht sind Jahre und Gebiete mit erhöhten Hantavirus-Erkrankungszahlen identifiziert worden. Das Puumala-Orthohantavirus (PUUV) verursacht im westlichen, südlichen und nordwestlichen Teil Deutschlands in bestimmten Jahren (Ausbruchsjahre) eine deutlich erhöhte Zahl von Hantavirus-Erkrankungen. Das Dobrava-Belgrad-Orthohantavirus (DOBV) kommt, wegen der Verbreitung der Brandmaus, nur im östlichen Teil Deutschlands vor. Kürzlich wurde in Deutschland eine von einer Heimratte (Wanderratte) übertragene SEOV-Erkrankung beschrieben. Das Robert Koch-Institut stellt aktuelle und historische Erkrankungszahlen in einem Onlinetool bereit (survstat.rki.de). Die gemeinsamen Untersuchungen des Konsiliarlaboratoriums für Hantaviren/Charité, des Julius Kühn-Instituts und des Friedrich-Loeffler-Instituts haben zur Erstellung eines Katasters von Hantavirusvorkommen im Tierreservoir in Deutschland geführt. Diese Untersuchungen führten zur Ermittlung der gegenwärtigen Verbreitung des PUUV und des DOBV, Genotyp Kurkino. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
Die Vermeidung von Hantavirus-Erkrankungen basiert auf der Expositionsprophylaxe. Insbesondere in „Hantavirusjahren“ wird hierauf auch durch den öffentlichen Gesundheitsdienst in Endemie-regionen verstärkt hingewiesen. Ein wichtiger Schwerpunkt ist die Vermeidung des Eindringens von (potenziell Hantavirus-infizierten) Nagetieren in Wohn- und Arbeitsräume. Bei besonders gefährlichen Tätigkeiten ist das Tragen einer Atemschutzmaske zu empfehlen. Weitere Hinweise finden Sie auf dem Merkblatt „Wie vermeide ich Hantavirus-Infektionen?“ |
|
Wo liegen zukünftige Herausforderungen? |
|
Für die fachliche Unterstützung bei der Erstellung des Hantavirus Steckbriefes danken wir Prof. Dr. Rainer G. Ulrich (Friedrich-Loeffler-Institut (FLI)),Dr. Mirko Faber (Robert Koch-Institut), Dr. Jens Jacob (Julius Kühn-Institut), Prof. Dr. Jörg Hofmann (Charité, Berlin), Dr. Johannes Dressman (Niedersächsisches Landesgesundheitsamt, NGLA), Dr. Christiane Klier (NGLA), Kathrin Jeske (FLI) und Dr. Stephan Drewes (FLI).
Januar 2021 - Coxiella burnetii
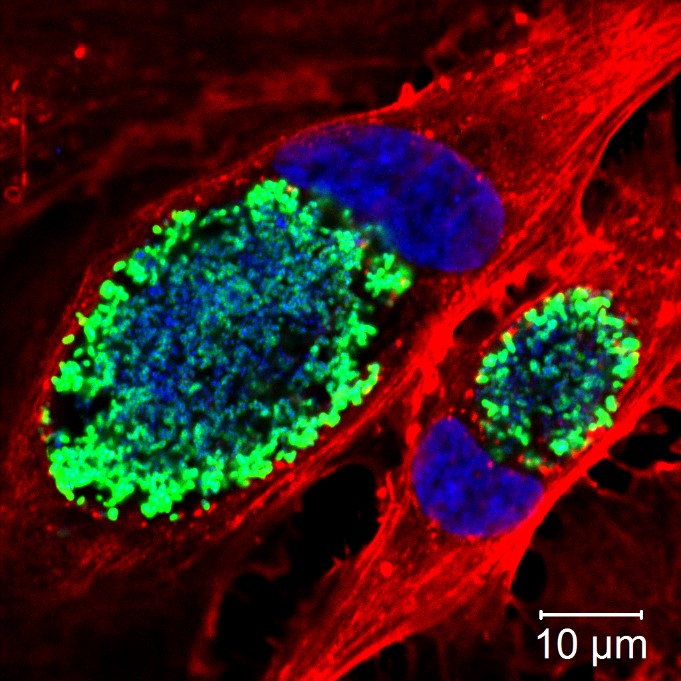
Humane Endothelzellen infiziert mit Coxiella burnetii. Zellen wurden markiert mit Antikörpern gegen C. burnetii (grün), Aktin (rot) und DAPI (blau). DAPI markiert den Zellkern der infizierten Zellen, in denen sich jeweils eine große mit C. burnetii gefüllte Vakuole befindet. Bild: Q-Gaps
|
Beschreibung |
|
Coxiella (C.) burnetii ist ein obligat intrazelluläres Gram-negatives Bakterium (Familie Coxiellaceae, Ordnung Legionellales, Klasse Gammaproteobakterien) und der Erreger des Q-Fiebers. Der Erreger kann in zwei antigenen Formen existieren: Phase I und Phase II. Diese sog. Phasenvarianz basiert auf der Lipopolysaccharidstruktur (LPS) der äußeren Zellmembran. Bakterien mit einem kompletten, langkettigen LPS werden als Phase I bezeichnet und sind virulent. Bakterien der Phase II weisen ein stark verkürztes LPS auf und sind weitgehend avirulent. Coxiellen können Monozyten und Makrophagen invadieren und sich im sauren Milieu des Phagolysosoms vermehren. Zwei Entwicklungsstadien werden morphologisch unterschieden, die „Small-Cell-“Variante (SCV) und die „Large-Cell-“Variante (LCV). Die SCV ist die extrazelluläre, umweltresistente Form, die über Monate in der Umwelt, wie Staub und Heu, persistieren und infektiös bleiben kann, während die LCV als stoffwechselaktive, vermehrungsfähige intrazelluläre Form angesehen wird. Der Erreger wird in die Risikogruppe 3 eingestuft und zählt aufgrund seiner geringen Infektionsdosis, Umweltstabilität und Luftübertragbarkeit zu den potenziellen biologischen Kampfstoffen (Bioterrorismus). |
|
Erstmals entdeckt |
|
Das Q-Fieber wurde als erstes vom australischen Forscher Edward Derrick beschrieben, der die Erkrankung bei Schlachthausarbeiter*innen in Australien beobachtete. (Derrick EH. “Q” fever, a new fever entity: clinical features, diagnosis, and laboratory investigation. Med J Aust. 1937;2: 281–99). Da Derrick die beobachteten Symptome keiner bekannten Krankheit zuordnen konnte, wurde die Erkrankung als Q-Fieber, für „query“- unbestimmt, bezeichnet. C. burnetii wurde später nach dem amerikanischen Bakteriologen Herald Rea Cox und dem australischen Arzt Frank Macfarlane Burnet benannt, die beide unabhängig voneinander das Bakterium in den 1930er Jahren isoliert haben. Burnet FM, Freeman M (1937). "Experimental studies on the virus of "Q" fever". Med J Aust. 2 (4): 299–305; Davis, Gordon E.; Cox, Herald R.; Parker and R. E. Dyer, R. R.; Dyer, R. E. (1938). "A Filter-Passing Infectious Agent Isolated from Ticks". Public Health Reports. Association of Schools of Public Health. 53 (52): 2259–82 |
|
Wo kommt der Erreger vor? |
|
Coxiella burnetii kommt mit Ausnahme von Neuseeland und Antarktis weltweit vor. |
|
Betroffene Tierspezies, Reservoir |
|
Hauswiederkäuer (Schafe, Ziegen und Rinder) scheiden den Erreger besonders während der Geburt oder eines Abortes in großen Mengen mit Geburtsflüssigkeiten und Nachgeburt aus. Zusätzlich erfolgt die Ausscheidung über Milch, Urin und Kot. Besonders bei Schafen kann eine Infektion mit Coxiella burnetii komplett symptomlos verlaufen, sodass ohne eine regelmäßige Probenuntersuchung nicht unbedingt bemerkt wird, ob die Tiere den Erreger ausscheiden. Dennoch sind Fehlgeburten, Totgeburten, Geburten lebensschwacher Neugeborener und der verzögerte Abgang der Nachgeburten als mögliche Anzeichen für Q-Fieber bei Hauswiederkäuern ernst zu nehmen. Auch andere Haus- und Wildsäugetiere (wie z.B. Katzen, Insekten und Spinnentiere können den Erreger ausscheiden, bilden aber nicht das Hauptreservoir für Infektionen beim Menschen. Die Übertragung durch Zecken ist noch nicht eindeutig geklärt. Jedoch dürfte vor allem der Zeckenkot eine wesentliche Rolle bei der Verbreitung von C. burnetii spielen. Infizierte Zecken können große Erregermengen mit dem Kot ausscheiden. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Menschen infizieren sich hauptsächlich durch das Einatmen von bakterienhaltigen Stäuben oder Tröpfchen. Deshalb besteht besonders ein Risiko für Personen, die sich in unmittelbarer Nähe von erregerausscheidenden Hauswiederkäuern (Schafe, Ziegen, Rindern) aufhalten. Zudem werden erregerhaltige Stäube mit dem Wind weit verbreitet, so dass sich auch Menschen ohne Bezug zur Wiederkäuerhaltung mit C. burnetii infizieren können. Darüber hinaus kann der Erreger durch Ausbringen von Mist, der nicht ausreichend durcherhitzt war sowie während der Schafschur freigesetzt werden. Infektionen durch den Verzehr von Rohmilch- und Rohmilchprodukten sind äußerst selten und das Risiko wird als äußerst gering eingestuft (BfR). Personen, die berufsbedingt Kontakt zu Schafen, Ziegen oder Rindern bzw. Materialien dieser Tiere haben, wie beispielsweise Tierhalter*innen, Schäfer*innen, Scherer*innen, Tierärzt*innen und ihre Mitarbeiter*innen, Labormitarbeiter*innen sowie Schlachthofarbeiter*innen, haben ein erhöhtes Risiko für eine Coxiella burnetii-Infektion. |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Akutes Q-Fieber beim Menschen: Nach einer Inkubationszeit von 1-3 Wochen zeigen ca. 40 % der Infizierten klinische Symptome, während bei den übrigen Fällen die Infektion asymptomatisch verläuft. Klinische Beschwerden äußern sich in Form von grippeähnlicher Symptomatik wie starken retroorbitalen Kopfschmerz, Fieber, Mattigkeit, Gliederschmerzen und Schüttelfrost. Bei ca. 10-20 % der symptomatischen Fälle tritt eine atypische Pneumonie und/oder granulomatöse Hepatitis auf. Sehr selten führt die Infektion zu einer Myokarditis, Perikarditis oder Meningoenzephalitis. Die Infektion während der Schwangerschaft kann das Risiko für eine Fehlgeburt (meist bei einer Erstinfektion im ersten Schwangerschaftsdrittel), eine Frühgeburt, eine Plazentitis (Entzündung der Plazenta), die in der Folge zum Abort führen kann, oder ein geringes Geburtsgewicht des Neugeborenen erhöhen. Eine Übertragung im Mutterleib mit Spätfolgen für das Kind wurde bisher nicht beschrieben. Eine akute Coxiella burnetii-Infektion führt in ca. 1 % der Fälle zu einem chronischen Q-Fieber d.h. einer Chronifizierung (mehr als 6 Monate persistierende Infektion), die sich sehr häufig in Form einer Endokarditis klinisch manifestiert. Sehr viel seltener treten z.B. eine granulomatöse Hepatitis oder eine Osteomyelitis auf. Die chronische Erkrankung ist langwierig zu therapieren (mehrere Jahre) und weist in Verbindung mit einer hohen Komplikationsrate unbehandelt eine Mortalität von bis zu 40 % auf. Nach einem akuten Q-Fieber kann zusätzlich ein Post-Q-Fieber-Müdigkeitssyndrom (Q fever fatigue syndrome – QFS) auftreten. Die häufigsten Symptome des QFS umfassen: Müdigkeit (Fatigue), Beeinträchtigung im Alltag, Konzentrationsschwäche, Muskelschmerzen, Nachtschweiß. Auch wird oft von Betroffenen geschildert, dass das vor der Erkrankung vorhandene Leistungs- und Arbeitsniveau nach einem Jahr nicht wieder erreicht wurde. Bei Tieren können die Symptome ganz unterschiedlich ausgeprägt sein. Besonders bei Schafen kann eine Infektion mit C. burnetii ohne klinische Anzeichen einer Erkrankung verlaufen. Bei Ziegen kommt es häufig zur Geburt lebensschwacher Lämmer und zu Aborten. Das klinische Bild fällt beim Rind sehr unterschiedlich aus und reicht von symptomlos über verlängerte Zwischenkalbezeit, Nachgeburtsverhalten bis hin zum Abort. Im Gegensatz dazu, kommt es bei Ziegen und Rindern häufig zum Abort. Generell können folgende Symptome mit Q-Fieber bei Hauswiederkäuern in Verbindung gebracht werden: Fertilitätsprobleme, Fehlgeburt, Totgeburt, Geburt lebensschwacher Lämmer bzw. Kälber, verzögerter Abgang der Nachgeburt. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Beim Menschen ist eine akute C. burnetii-Infektion mit Antibiotika (z.B. Doxycyclin) gut behandelbar. Im Fall eines chronischen Verlaufs sowie bei Vorerkrankungen oder bei einer Erkrankung vor/während einer Schwangerschaft ist eine langandauernde Antibiotika-Therapie notwendig. Ein Impfstoff für Menschen ist nur in Australien zugelassen und gegebenenfalls mit Nebenwirkungen verbunden. Die Erregerausscheidung beim Tier kann, nach aktuellem Stand der Wissenschaft, durch Medikamentengabe nicht verhindert werden. Eine Behandlung mit Oxytetrazyklin führt nicht zu einer signifikanten Reduzierung der Erregerausscheidung. Ein Impfstoff ist in Deutschland für Rinder und Ziegen zugelassen und kann für Schafe umgewidmet werden. Dieser Impfstoff senkt die Erregerausscheidung der Tiere langfristig, kann sie aber nicht vollständig verhindern. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Akutes Q-Fieber beim Menschen ist eine in der Bundesrepublik Deutschland nach dem Infektionsschutzgesetz (IfSG) meldepflichtige Erkrankung. Dem Gesundheitsamt wird gemäß § 7 Abs. 1 IfSG der direkte oder indirekte Nachweis von C. burnetii, soweit er auf eine akute Infektion hinweist, namentlich gemeldet. In der Veterinärmedizin ist der direkte Nachweis von C. burnetii bei Wiederkäuern in Deutschland nach der Verordnung über meldepflichtige Tierkrankheiten (TKrMeldpflV) meldepflichtig. Dabei sind die Leiter der Veterinäruntersuchungsämter, der Tiergesundheitsämter oder sonstiger öffentlicher oder privater Untersuchungsstellen , die in Ausübung ihres Berufes meldepflichtige Krankheiten feststellen, verpflichtet, das Auftreten der Krankheit oder des Erregers unverzüglich der nach Landesrecht zuständigen Behörde unter namentlicher Angabe des betroffenen Bestandes, des Datums der Feststellung der betroffenen Tierarten und des Kreises oder der kreisfreien Stadt zu melden. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
|
Welche Bekämpfungsstrategien gibt es? |
|
Voraussetzung für die Maßnahmen der Verhütung und Bekämpfung dieser Infektion beim Menschen ist das rechtzeitige Erkennen von Infektionen bei Tieren. Die Vermeidung des Kontaktes zu erregerausscheidenden Tieren stellt die wichtigste Vorbeugungsmaßnahme dar. Beim Auftreten von Q-Fieber-Erkrankungen ist eine enge Zusammenarbeit von Gesundheitsamt und Veterinäramt erforderlich, um die Infektionsquelle aufzuspüren und weitere Erkrankungsfälle in der Bevölkerung zu verhindern. Eine zentrale Bekämpfungsstrategie beinhaltet die Beachtung von Schutz- und Hygienemaßnahmen bei Geburtshilfe und Schur. Bei einem Erregernachweis ist auch das Desinfizieren der Stallungen, Arbeitsmaterialien und Arbeitskleidung essentiell. Zusätzlich sollten Rohmilch oder Rohmilchprodukte nicht mehr an den Verbraucher abgegeben werden. Pasteurisieren inaktiviert C. burnetii. Eine Impfung der Schafe, Ziegen und Rinder wird empfohlen. |
|
Wo liegen zukünftige Herausforderungen? |
|
Aufgrund der unspezifischen Symptome kann das Q-Fieber beim Menschen leicht mit einem grippalen Infekt verwechselt werden, so dass gegebenenfalls eine adäquate Behandlung mit Antibiotika nicht frühzeitig begonnen werden kann, um z.B. den möglichen Übergang in ein chronisches Q-Fieber zu verhindern. Das Post-Q-Fieber-Müdigkeitssyndrom (Q fever fatigue syndrome – QFS) stellt diagnostisch und therapeutisch eine Herausforderung dar, da sich die Erkrankung durch Antibiotikagabe nicht beeinflussen lässt und kein eindeutiger Labornachweisparameter existiert. Deshalb werden psychosomatische und verhaltenstherapeutische Behandlungsansätze empfohlen.
Weitere Informationen:
|
Für die fachliche Unterstützung bei der Erstellung des Coxiella burnetii-Steckbriefes danken wir dem Q-GAPS Konsortium, insbesondere PD Dr. Anja Lührmann (Universitätsklinikum Erlangen).
Dezember 2020 - Trichophyton benhamiae
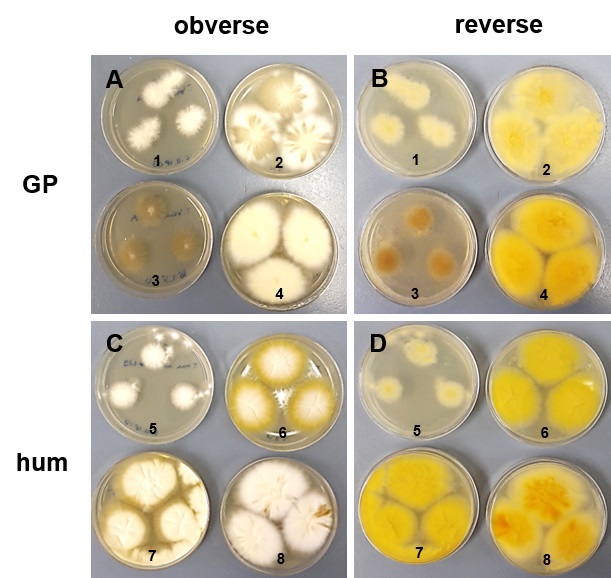
8 unterschiedliche T. benhamiae Isolate, 4 vom Meerschweinchen (GP) und 4 von Menschen (hum), gezeigt ist Ober- (obverse) und Unterseite (reverse), (Bild: C. Baumbach, Uni Leipzig)
|
Beschreibung |
|
Trichophyton benhamiae ist ein zoophiler Dermatophyt (Fadenpilz, der Pilzinfektion der Haut auslösen kann). Er kommt in zwei Varianten vor:
Seine Morphologie ist leicht mit anderen Pilzen zu verwechseln (M. canis, T. mentagrophytes) weshalb eine Differenzierung mittels molekularbiologischer Methoden empfohlen wird (insbesondere Sequenzierung best. Genregionen). |
|
Erstmals entdeckt |
|
T. benhamiae wurde erstmals 1998 von einem Kaninchen in Japan isoliert. 2002 wurde der Erreger erstmals von zwei menschlichen Patienten mit Tinea corporis (Dermatophytose von Rumpf und Extremitäten) in Japan isoliert. Diese hatten sich vermutlich an einem Kaninchen infiziert. |
|
Wo kommt der Erreger vor? |
|
Der Erreger ist weltweit verbreitet. |
|
Betroffene Tierspezies, Reservoir |
|
Als Erregerreservoir dienen vorrangig kleine Nagetiere, vor allem Meerschweinchen, aber auch andere Nager und Kleinsäuger. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Eine Infektion erfolgt vorrangig durch direkten Kontakt mit asymptomatischen oder infizierten Tieren. Zudem kann es zu einer Infektion über unbelebte Vektoren kommen, wie Einstreu oder Gegenstände im Käfig. Die Sporen der Pilze sind sehr widerstandsfähig und können bis zu mehrere Jahre bei unzureichender Reinigung und Desinfektion überdauern. Häufig betroffen sind Kinder und Jugendliche, was vermutlich auf einen oft engen Kontakt mit ihren Haustieren zurückzuführen ist (es ist nicht abschließend geklärt, ob sie ggf. auch besonders empfänglich sind). Gefährlich kann eine Infektion für immunsupprimierte Patienten werden. |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
T. benhamiae löst vor allem bei Kindern und Jugendlichen Dermatophytosen aus. Am häufigsten sind hierbei sind Tinea corporis und Tinea faciei. Hierbei kommt es zu Entzündungen der Haut (rundliche, abgegrenzte Hautläsionen) am Körper und im Gesicht mit teilweise starkem Juckreiz. In einigen Fällen sind auch Kopfhaut und Haare betroffen (Tinea capitis) bis hin zu Kerion celsi (entzündlich-eitrige Kopfhautinfektion, oft mit dauerhaftem Haarausfall). Da alle genannten Merkmale mehr oder weniger stark auftreten können, kann das Krankheitsbild sehr variabel ausfallen. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt verschiedene gut wirksame Medikamente. Hierbei sollte die Pilzart genau differenziert werden, um der Entstehung von Resistenzen entgegen zu wirken. Die Wirkstoffe werden häufig in Form von Cremes (Amorolfin, Clotrimazol, Ciclopiroxolamin, Naftifin etc.) verschrieben. Bei schwerer oder renitenten Fällen können die Wirkstoffe auch systemisch verabreicht werden (Terbinafin, Itraconazol, Fluconazol). Die größte Herausforderung für eine erfolgreiche Therapie ist die notwendige lange Behandlungsdauer (mehrere Wochen bis Monate, bei Nagelpilz auch über ein Jahr), was oft zu einer fehlenden Compliance bei den Patienten führt. Einen humanen Impfstoff gibt es nicht. Für manche Tierarten gibt es Impfstoffe, welche jedoch keine Re-Infektion verhindern, sondern lediglich Symptome und Infektionsdauer verkürzen können. Dermatophytosen sind teilweise auch selbstausheilend, sollten aber aufgrund der hohen Ansteckungsgefahr dennoch behandelt werden. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Dermatophytosen sind nicht meldepflichtig, nur in besonderen Fällen, wenn z.B. mehrere Kinder in kurzen Abständen aus derselben Kita mit denselben Symptomen beim gleichen Arzt vorstellig werden. Die tatsächlichen Infektionszahlen können daher höher liegen als offiziell angegeben. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Ein Forschungsbereich ist der Einfluss von bestimmten Prädisposition (Stress, Alter) auf die Infektion mit T. benhamiae. Ein weitere Forschungsfrage ist, was zu einer Chronizität der Infektion führt. Aber auch Virulenzfaktoren und geeignete experimentelle Systeme, die den in vivo Zustand real abbilden, sind Themen in der Forschung. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Ein wichtiger Ansatzpunkt ist die Prävention. Hierbei ist es wichtig, Menschen für die Gefahr von Pilzinfektionen zu sensibilisieren, damit sie im Schwimmbad Badeschlappen tragen und in den Skiurlaub den eigenen Helm und Schuhe mitnehmen, die eigene Haarbürste alleine nutzen, in Saunen und Fitnessstudios auf geeignete Unterlagen achten, nicht einfach so fremde Tiere streicheln und beim Neukauf von Haustieren (v.a. Meerschweinchen) einen prophylaktischen Besuch beim Tierarzt in Erwägung ziehen. Bei der Behandlung von Erkrankten ist es wichtig, dass diese stringent den Anweisungen des behandelnden Arztes folgen. Auch eine gründliche Reinigung und Desinfektion der Umgebung von infizierten Patienten (Kleidung, Kuscheltiere, und Sofas u. ä.) ist wichtig. |
|
Wo liegen zukünftige Herausforderungen? |
|
Für die Zukunft sollte eine exakte Diagnostik in Routinelaboren implementiert werden, um Fehldiagnosen zu vermeiden. Diese beeinträchtigen nach wie vor epidemiologische Studien und weiterführende Forschung. Zudem ist es wichtig Hautärzte auf das Thema zu sensibilisieren und insbesondere nach Aufenthalten in wärmeren Ländern aufmerksam zu sein (dort sind einige Dermatophyten weiter verbreitet als in Deutschland). In Indien sind bereits resistente Hautpilze auf dem Vormarsch, die weite Teile der Bevölkerung befallen. Auch hier ist es wichtig Achtsamkeit zu praktizieren, um der weiteren Verbreitung von resistenten Pilzerregern vorzubeugen. |
Für die fachliche Unterstützung bei der Erstellung des Toxoplasmose Steckbriefes danken wir Christina Baumbach (Universität Leipzig) und Prof. Dr. Pietro Nenoff (Universitätshautklinik Leipzig)
November 2020 - FSME-Virus

3 Stadien (Larve, Nymphe, adulte Männchen/Weibchen) von Ixodes ricinus, der wichtigste Überträger des FSME-Virus in Mitteleuropa (Bild: PD Dr. G. Dobler, Institut für Mikrobiologie der Bundeswehr)
|
Beschreibung |
|
Das Frühsommer-Meningoenzephalitis (FSME)-Virus ist Mitglied des Genus Flavivirus, der Familie Flaviviridae. Es wird in die „Mammalian Tick-borne group“ eingruppiert. Insgesamt gibt es mindestens 5 Subtypen (Europäischer, Sibirischer, Fernöstlicher, Baikal, Himalaya). Es handelt sich um ein behülltes Virus. Sein Genom enthält ca. 11.000 Nukleotide (nt) in Form einer Einzelstrang RNA positiver Polarität. |
|
Erstmals entdeckt |
|
Die Erstbeschreibung des FSME-Virus erfolgte 1930 durch Hans Schneider in Neunkirchen, Niederösterreich („Schneidersche Krankheit“). 1937 wurde das Virus von Prof. Dr. Lev Zilber im Fernen Osten Russlands, bei Khabarovsk, beschrieben. Die Entdeckung des FSME-Naturherds erfolgte 1938 durch Prof. Evgenji Pawlowsky. 1949 gelang die Erstisolierung des FSME-Virus in Europa durch Dr. Frantisek Gallia in der Tschechoslowakei. |
|
Wo kommt der Erreger vor? |
|
Der Erreger kommt auf dem eurasiatischen Kontinent im sogenannten borealen Nadelwaldgürtel von England im Westen bis Japan im Osten vor. Im Norden reichte seine Verbreitung bis Schweden und Finnland. Im Süden erstreckt sich das Verbreitungsgebiet bis zum Mittelmeer, Schwarzes Meer, Transkaukasien, Mongolei und Südkorea. |
|
Betroffene Tierspezies, Reservoir |
|
Vektor und Reservoir des FSME-Virus sind verschiedene Schildzeckenarten. In Mitteleuropa ist es vor allem Ixodes ricinus, in Russland v.a. Ixodes persulcatus und in Japan und Südkorea Ixodes ovatus. Seltener sind auch Buntzecken (Dermacentor)-Arten Reservoir des Virus (u.a. Dermacentor reticulatus in Sachsen, Sachsen-Anhalt, Russland, Mongolei u.a.). Natürliche Wirte für das Virus sind Kleinsäuger, u.a. Rötelmaus, Gelbhalsmaus, und Insektivoren. Mensch und größere Wildtiere und Haustiere gelten als zufällige Fehlwirte, die nicht an der Zirkulation des FSME-Virus beteiligt sind. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Natürliche Infektion erfolgen überwiegend durch Zeckenstich, seltener auch durch Verzehr unbehandelter Milch und Milchprodukte von Haustieren (Ziegen, Kühe, Schafe). Zudem sind Laborinfektionen durch Aerosol und Penetration virushaltiger Materialien durch die Haut möglich. Risikogruppen sind alle Personen, die Kontakt mit der Vegetation und damit mit Zecken haben. Vor Einführung der Impfung waren v.a. Waldarbeiter und Landwirtschaftsarbeiter betroffen. Durch die Impfung der Risikogruppen kommen heute ca. 90% der Infektionen durch Freizeitaktivitäten zustande (Pilzsuchen, Wandern, Gartenarbeit, Spazierengehen). |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Neben dem Menschen sind selten Hunde, Pferde, sehr selten Schafe und evtl. Mufflons betroffen. Hier kann es zu einer Enzephalitis kommen. Beim Menschen ist häufig ein biphasischer Verlauf zu beobachten. Bei der ersten Phase handelt es sich um einen unspezifischen Allgemeininfekt und bei der zweiten Phase um eine Organphase (Meningitis, Enzephalitis, Myelitis). Die Letalität in Europa liegt bei ca. 1-2%. In Russland liegt sie Letalität durch sibirische und fernöstliche Subtyp-infektionen möglicherweise bei bis zu 20%. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Es gibt keine ursächlich wirksamen Medikamente gegen das FSME-Virus. Als Therapie kommt alleinig die medikamentöse Behandlung von Symptomen zur Anwendung, die den Verlauf der Erkrankung nicht grundlegend verändern kann. Es sind 2 Impfstoffe (jeweils als Erwachsenen- und Kinder-Impfstoff) verfügbar, die nach kompletter Grundimmunisierung einen Impfschutz von > 95% aufweisen. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Die FSME ist in der gesamten EU meldepflichtig. In Deutschland ist die diagnostisch nachgewiesene FSME-Infektion meldepflichtig. Die Meldung erfasst ausschließlich humane Fälle auf Landkreisebene. Der Nachweis von FSME-Virus in Zecken oder der Nachweis von Antikörpern in Wild-/Haustieren sind nicht meldepflichtig. Nachdem der Mensch ein Fehlwirt für das FSME-Virus ist, zielt das deutsche Meldesystem nur auf humane Fälle und nicht auf die eigentliche Verbreitung des FSME-Virus ab. Als Risiko-Landkreise werden Landkreise bezeichnet die in 5 Jahren eine Inzidenz von 1/100.000 überschreiten. Landkreise mit einzelnen Erkrankungsfällen werden damit nicht als Risiko-Landkreise erfasst. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Aktuell gibt es noch eine große Anzahl an Forschungsfragen: Welche geographische Ausdehnung haben FSME-Naturherde und wie werden diese Herde über Jahrzehnte stabil gehalten? Welche Faktoren führen zu einer Anpassung des VFSME-Virus an Vektoren und Wirtstiere? Welche Auswirkungen haben die Änderungen des Wetters der letzten Jahre auf die Epidemiologie der FSME (sowohl Auftreten neuer als auch Verschwinden bekannter Risikogebiete)? Wie breitet sich das FSME-Virus aus? Welche epidemiologischen Risikofaktoren gibt es für FSME in unserer modernen Gesellschaft? Gibt es Virusstämme mit unterschiedlicher Pathogenität in der Natur? Wie und warum ist das FSME-Virus neuropathogen? |
|
Welche Bekämpfungsstrategien gibt es? |
|
Zum einen ist die Aufklärung über das Risiko von FSME-Infektionen eine wichtige Maßnahme. Zum anderen ist die Identifizierung von Risikofaktoren für humane FSME-Infektionen wichtig. Auch eine gezielte Propagierung der FSME-Impfung bei Populationen mit erhöhtem Infektions-Risiko kann einen wichtigen Beitrag leisten. Zudem wird die experimentelle Eliminierung von FSME-Naturherden durch den Einsatz biologischer Maßnahmen untersucht (Zeckenbekämpfung, Nagetier-Bekämpfung). |
|
Wo liegen zukünftige Herausforderungen? |
|
In den vergangenen 3 Jahren konnte eine dramatische Zunahme der Zeckenpopulationen mit gesteigertem Risiko von FSME-Infektionen beobachtet werden mit einem tendenziell deutlichen Anstieg der FSME-Fälle in höher gelegenen Regionen Deutschlands. Die Bedeutung des Klimawandels für die Verbreitung von Vektoren, natürlichen Wirten und auf die Replikation des Virus im Naturzyklus muss zukünftig beachtet werden. Zudem ist eine verbesserte Impfprophylaxe durch besseres Verstehen von Pathogenitäts- und Immunitätsmechanismen ein zukünftiges Ziel, sowie die verbesserte Durchimpfungsraten in Risiko-Landkreisen durch innovative Aufklärungsstrategien. Auch die Entwicklung von antiviral wirksamen Medikamenten gegen FSME-Virus (und andere Flaviviren) ist ein wichtiges Thema, sowie das verbesserte Verstehen des FSME-Virus- Übertragungszyklus zur Etablierung ökologischer Bekämpfungsmaßnahmen in Naturherden. |
|
Sonstiges |
|
Weitere Informationen können auf der Seite des Nationalen Konsiliarlabors für Frühsommer-Meningoenzephalitis (FSME) des Instituts für Mikrobiologie der Bundeswehr gefunden werden. |
Für die fachliche Unterstützung bei der Erstellung des FSME-Virus Steckbriefes danken wir PD Dr. Gerhard Dobler, Leiter des Nationales Konsiliarlabor für Frühsommer-Meningoenzephalitis (FSME) am Institut für Mikrobiologie der Bundeswehr.
Oktober 2020 - Toxoplasma gondii
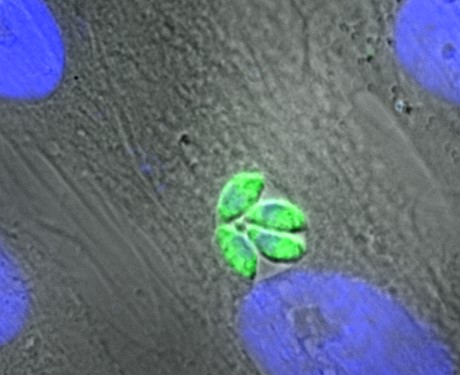
Toxoplasma gondii in seinem pathogenen Stadium als Tachyzoit (in grün). Grau: Wirtszellen, blau: Zellkerne der Wirtszellen und des Parasiten (Bild: M. Blume (RKI))
|
Beschreibung |
|
T. gondii ist ein obligat intrazellulärer Parasit, der im Laufe seines Lebenszyklus sehr verschiedene Erscheinungsformen einnimmt. Er gehört zu den sogenannten Apicomplexa zu denen auch Erreger der Malaria und Kryptokkose gehören. |
|
Erstmals entdeckt |
|
T. gondii wurde erstmals 1902 von Charles Nicolle und Louis Manceaux als Parasit in dem afrikanischen Nager Gundi entdeckt. |
|
Wo kommt der Erreger vor? |
|
Der Erreger ist weltweit verbreitet. Besonders diverse und virulente Stämme des Parasiten kommen auf dem südamerikanischen Kontinent vor. |
|
Betroffene Tierspezies, Reservoir |
|
T. gondii infiziert alle warmblütigen Tiere, inklusive dem Menschen. Besondere Bedeutung kommt katzenartigen Wirtstieren zu. Nur sie scheiden nach Infektion sogenannte Oozysten aus. Diese Form des Parasiten ist die einzige außerhalb von Wirtstieren vorkommende und umweltstabile Form des Parasiten. Sie sind das Produkt seines sexuellen Vermehrungszyklus, der exklusiv im Darmepithel von Katzen stattfindet. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
Infektionen mit T. gondii finden durch Aufnahme kontaminierter Nahrung statt. Dabei werden entweder Oozysten aus der Umwelt oder sog. Gewebszysten aus ungenügend gegarten Fleischprodukten mit der Nahrung aufgenommen. Risikogruppen mit potentiell schwerem Krankheitsverlauf sind immunsupprimierte Personen und Schwangere. So treten in ersteren oft schwere neuronale Schäden durch eine rasche Vermehrung des Parasiten auf, die unbehandelt zu einem tödlichen Krankheitsverlauf führen können. Risikogruppen mit erhöhten Serokonversionsraten beinhalten Gruppen mit geringerem sozioökonomischem Status und die Landbevölkerung. In allen einmal infizierten Personen oder Tieren überdauert der Parasit innerhalb von Gewebszysten. Das führt zu einer geschätzten Prävalenz von ca. 30% weltweit und einer 50%igen Seroprävalenz in Deutschland. |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
Eine akute Toxoplasmose manifestiert sich in unspezifischen Symptomen, die monatelang anhalten können und Fieber und Schmerzen in Gelenken und Muskeln beinhalten. In sonst gesunden Patienten ist die akute Toxoplasmose selbst limitierend und meist entweder symptomlos oder von leichten Grippe-ähnlichen Symptomen begleitet. Schwer verlaufende Formen mit besonders aggressiven Parasitenstämmen oder in immungeschwächten Patienten können allerdings bleibende neuronale Schäden, wie Blindheit und Taubheit, hinterlassen oder tödlich verlaufen. Eine Primärinfektion von Schwangeren kann abhängig vom Infektionszeitpunkt und Behandlungsbeginn zu schweren Fehlbildungen oder Todgeburten führen. Vereinzelt tritt auch eine Infektion der Retina in sonst gesunden Patienten auf, die mit einer Einschränkung des Sehvermögens verbunden ist. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Wie für alle eukaryotischen Krankheitserreger, gibt es derzeit keinen für Menschen zugelassenen Impfstoff gegen Toxoplasmose. Für Schafe ist mit ToxoVac ein Lebendimpfstoff, basierend auf einem attenuierten Parasitenstamm, zugelassen. Akute Infektionen mit T. gondii können mit dem Malariamedikament Atovaquone, mit Antifolaten, wie zum Beispiel Pyrimethamin, oder insbesondere bei Schwangeren mit Spiramycin behandelt werden. Diese Behandlungen sind nicht gegen chronisch infektiöse Gewebszysten aktiv, so dass es jeder Zeit du einem erneuten Krankheitsausbruch kommen. Es existiert momentan keine Therapie, die chronisch infektiöse Gewebszysten vollständig abtötet. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Deutschlandweit ist die konnatale Toxoplasmose meldepflichtig. Die akute Toxoplasmose ist dagegen nur in Sachsen meldepflichtig. Derzeit finden im Rahmen von KiGGS , DEGS und GERN Studien des Robert Koch-Instituts repräsentative Erhebungen der Serumprävalenzen in Deutschland statt. Dabei werden Antikörper gegen T. gondii in Blutproben nachgewiesen, welche auf eine stattgefundene Infektion deuten. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Toxoplasma dient als Modellorganismus für eine Reihe Apicomplexer Parasiten zu denen auch die Erreger der Malaria und Cryptosporidiose zählen. Dabei wird auf der Suche nach essentiellen Proteinen und Prozessen die ausgezeichnete genetische Zugänglichkeit T. gondiis in CRISPR-basierten Screens ausgenutzt. Ziel ist es Angriffspunkte für potentielle Wirkstoffe zu identifizieren. Ein Schwerpunkt stellt dabei die Invasion und der Exit aus Wirtszellen dar, deren Mechanismus in groben Zügen in Apicomplexa ähnlich ist. Eine weitere zentrale Fragestellung ist die nach molekularen Grundlagen und Mechanismen der Persistenz und Resistenz von Gewebszysten T. gondiis. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Eine zentrale Bekämpfungsstrategie sind Hygienemaßnahmen. So wird empfohlen potentiell mit Oozysten kontaminiertes Obst und Gemüse vor dem Verzehr zu waschen. Außerdem sollten Gewebszysten in Fleischprodukten durch vollständiges Garen bei Temperaturen über 65°C abgetötet werden. Schwangeren wird zudem empfohlen, das Säubern der Katzentoilette anderen Haushaltsmitgliedern zu überlassen, um Kontakt mit potentiell Oozysten-haltigen Kot zu minimieren. |
|
Wo liegen zukünftige Herausforderungen? |
|
Aktuelle Herausforderungen liegen in dem Eindämmen der verhältnismäßig hohen Prävalenz in Deutschland. Dafür ist ein vertieftes Verständnis des Beitrags von Infektionswegen nötig. Welcher Teil der Bevölkerung infiziert sich über eine Aufnahme von Oozysten oder Gewebszysten? Wesentlicher Bestandteil einer Strategie die Übertragungswege einzudämmen und ein Wiederaufleben akuter Toxoplasmose in chronisch infizierten Personen zu unterbinden beinhaltet sowohl die Entwicklung eines Wirkstoffes, der Gewebszysten eliminiert, als auch die Entwicklung von Impfstoffen für Nutztiere und Menschen. |
|
Sonstiges |
|
Weiter Informationen können auf den Seiten des Robert Koch-Institutes gefunden werden: https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Toxoplasmose.html |
Für die fachliche Unterstützung bei der Erstellung des Toxoplasmose Steckbriefes danken wir Dr. Martin Blume (Robert Koch-Institut).
September 2020 - Hepatitis E-Virus

Elektronenmikroskopische Aufnahme zweier HEV-Partikel (Dr. Ashish Gadicherla, BfR, Berlin)
|
Beschreibung |
|
Einzelsträngiges RNA-Virus aus der Familie Hepeviridae (Genus Orthohepevirus). Häufigste Ursache für akute Hepatitis weltweit. Beim Menschen kommen vor allem die Genotypen 1 bis 4 der Spezies Orthohepevirus A vor. |
|
Erstmals entdeckt |
|
HEV wurde 1978 nach einem Ausbruch in Indien zum ersten Mal als Nicht-Hepatitis A & Nicht-Hepatitis B-Virus identifiziert (Khuroo et al. 1980). Die fäkal-orale Übertragung wurde erstmals 1983 in einem Selbstversuch beschrieben (Balayan et al. 1983). |
|
Wo kommt der Erreger vor? |
|
Der Erreger kommt weltweit vor. Die Mensch-assoziierten Genotypen 1 und 2 sind in Afrika und Asien verbreitet. Die Genotypen 3 und 4 kommen sowohl bei Menschen als auch bei Tieren (Schwein, Wildschwein, Kaninchen, Rehwild u.a.) vor. Das Verbreitungsgebiet des Genotyps 3 ist Europa und Nordamerika. Genotyp 4 ist vor allem in Asien, insbesondere in China, zu finden. |
|
Betroffene Tierspezies, Reservoir |
|
HEV-ähnliche Viren wurden auch in Vögeln (Spezies Orthohepevirus B), Nagern und Carnivoren (Spezies Orthohepevirus C), Fledermäusen (Spezies Orthohepevirus D) sowie in Fischen (Genus Piscihepevirus) nachgewiesen. Für die zoonotischen Genotypen 3 und 4 stellen Schweine und Wildschweine das Hauptreservoir dar. Es wurde zudem eine Übertragung von Kaninchen-, Dromedar- und Ratten-assoziierten HEV auf Menschen beschrieben. |
|
Wie kann sich der Mensch infizieren? Gibt es Risikogruppen? |
|
In Europa stecken sich Menschen hauptsächlich über den Verzehr unzureichend erhitzter Fleischprodukte von Schwein und Wildschwein an. Daneben gibt es eine steigende Zahl an Infektionen über Bluttransfusionen. In Asien und Afrika erfolgt die Infektion in der Regel über kontaminiertes, fäkal verunreinigtes Trinkwasser. Immunsuppression und Vorschädigung der Leber erhöhen das Risiko für chronische Infektionen und fulminante Verläufe. Einem besonderen Risiko sind Schwangere ausgesetzt, bei denen es nach Infektion mit dem Genotyp 1 zu einem Anstieg der Mortalitätsrate auf 25-30% kommen kann (Aggarwal et al., 2007). |
|
Was für Krankheitssymptome zeigen infizierte Tiere und Menschen? |
|
In der Regel sind Infektionen mit HEV asymptomatisch und heilen folgenlos aus. Bei einer symptomatischen akuten Hepatitis treten zunächst unspezifische Krankheitszeichen wie Schwäche, Arthralgien, Myalgien oder Erbrechen auf. Im weiteren Verlauf zeigen sich Hepatitis-typische Symptome wie Ikterus, Pruritus, entfärbter Stuhl und dunkler Urin. In schweren Fällen kann es zu einem schweren Leberversagen kommen. Chronische Verläufe treten vor allem bei Immunsupprimierten meist nach Organtransplantationen auf. Zusätzlich werden extrahepatische Manifestationen beschrieben, z. B. das Gullain-Barre-Syndrom, Glomerulonephritis, Kryoglobulinämie sowie sporadische Fälle von Enzephalitis und Myopathie. Bei den meisten Tieren ist eine Infektion symptomlos. Eine Ausnahme stellt aviäres HEV dar, das beim Geflügel zur Vergrößerung der Milz (Splenomegalie) und Leber (Big Liver and Spleen Disease) und einer Verringerung der Eilegerate führen kann. |
|
Gibt es Medikamente oder einen Impfstoff? |
|
Chronische und akute Infektionen lassen sich in der Regel gut mit Ribavirin behandeln. Diese Behandlung ist jedoch für Schwangere kontraindiziert. Zudem wird bei chronisch infizierten Patienten eine zunehmende Zahl von Ribavirin-resistenten Virusvarianten beobachtet. Andere Substanzen wie pegyliertes Interferon oder Sofosbuvir – ein Inhibitor von Hepatitis C-Viren - haben nur begrenzte Wirksamkeit oder müssen noch in klinischen Studien auf ihre Wirksamkeit hin getestet werden. Zurzeit wird an verschiedenen Impfstoffkandidaten gearbeitet. Ein kommerzieller Impfstoff (Hecolin®), dessen Basis ein rekombinantes Kapsid-Protein des HEV ist, wurde bereits im Menschen getestet, er ist allerdings bislang nur in China zugelassen. Ein Grund liegt darin, dass dessen Wirksamkeit bislang nur gegenüber den Genotypen 1 und 4 gezeigt wurde. |
|
Wie gut ist das Überwachungssystem für diesen Erreger? |
|
Die HEV-Infektion wurde 2001 als meldepflichtige Erkrankung in Deutschland in das Infektionsschutzgesetz (IfSG) aufgenommen. In den letzten Jahren stiegen die in Deutschland gemeldeten HEV-Fälle jedoch deutlich an von 53 in 2004 bis über 3000 Fälle in 2019. Die starke Zunahme lässt sich u.a. durch eine erhöhte Aufmerksamkeit durch behandelnde Ärzte zurückführen. |
|
Was sind aktuelle Forschungsfragen/ -schwerpunkte? |
|
Neuere Studien deuten darauf hin, dass HEV in zwei Formen existiert: als unbehülltes Virion, das über den Kot ausgeschieden wird, und als ein membranumhülltes („quasi-enveloped“) Virion, das im Blut zirkuliert. Beide Virustypen sind infektiös, unterscheiden sich aber in der Art und Weise, wie sie Zellen infizieren. Bislang ist aber nicht bekannt über welchen Zellrezeptor das Virus-Attachment erfolgt. Auch über die Rolle des viruseigenen ORF3-Proteins gibt es nur wenige Erkenntnisse. Man weiß seit kurzem, dass es als Ionenkanal (Viroporin) für die Virusfreisetzung eine wichtige Rolle spielt. Eine aktuelle Fragestellung ist außerdem die Suche nach Ursachen für die schweren Verläufe und hohe Mortalität bei Schwangeren, die nur durch den Genotypen 1 ausgelöst werden. Weiterhin sind die speziellen Bedingungen zur Herstellung sicherer Lebensmittel aus Schweineprodukten Gegenstand aktueller Forschungen. |
|
Welche Bekämpfungsstrategien gibt es? |
|
Zunächst einmal stehen präventive Maßnahmen durch verbesserte Hygienebedingungen in betroffenen Regionen im Fokus. Für die Ausbreitung der Genotypen 1 und 2 in Asien und Afrika mit verheerenden Ausbrüchen sind die Versorgung mit sauberen Trinkwasser und die Verbesserung der sanitären Hygiene von zentraler Bedeutung. Da in westlichen Ländern in der Regel zoonotische Übertragungen auftreten, sollte vor allem bei bestehender Immunsuppression auf die ausreichende Erhitzung von Fleischprodukten geachtet werden. Zudem werden zurzeit verschiedene neue Wirkstoffe zur Behandlung von HEV getestet. Ein vielversprechender Kandidat ist dabei Silvestrol, ein Naturstoff, der aus Mahagonigewächsen extrahiert wird. Die antivirale Wirkung konnte bereits in vitro in HEV-infizierten menschlichen Leberzellen und in vivo mit humanisierten Mäusen erfolgreich nachgewiesen werden. |
|
Wo liegen zukünftige Herausforderungen? |
|
Nach wie vor fehlt ein von der WHO zugelassener und geprüfter Impfstoff, dessen Wirksamkeit für alle humanpathogenen Genotypen und für alle Altersgruppen nachgewiesen wurde. Gerade im Hinblick auf die weltweiten Flüchtlingsströme und teils prekären hygienischen Bedingungen in Flüchtlingslagern, die großer HEV-Ausbrüche zur Folge haben können (z.B. in Uganda und Sudan), ist die Entwicklung und Bereitstellung eines Impfstoffs von zentraler Bedeutung. |
Für die fachliche Unterstützung bei der Erstellung des HEV-Steckbriefes danken wir Dr. Martin Eiden (Friedrich-Loeffler-Institut) und Prof. Dr. Reimar Johne (BfR, Berlin).
In Deinen Augen fehlt noch ein wichtiger Erreger in unserer Liste? Du hast noch einen Expertenvorschlag für uns? Bitte schreibt uns Eure Anregungen und Wünsche gerne an zoonosenplattform@fli.de Stichwort "Zoonose des Monats".
Wir freuen uns auf Eure Vorschläge.