Dem Bauplan der Erreger auf der Spur
Etwa 98,5 Prozent unseres Erbguts haben wir mit Schimpansen gemeinsam, 85 Prozent mit einer Maus und noch ungefähr 50 Prozent unserer proteincodierenden Gene mit einer Banane. DNA-Sequenzierung dient jedoch nicht nur dazu, Verwandtschaftsgrade unter Lebewesen zu bestimmen, sondern auch, um Erreger von Infektionskrankheiten wie Viren und Bakterien aufzuspüren und zu charakterisieren. Das unter dem Dach des Forschungsnetzes Zoonotische Infektionskrankheiten geförderte Projekt ZooSeq hat sich vorgenommen, das sogenannte Next-Generation Sequencing (NGS) für die Zoonose-Forschung zu optimieren. Auch SARS-CoV-2 wurde mittels NGS sequenziert. Und wie wichtig die Variantenanalyse ist, zeigt sich aktuell beständig.
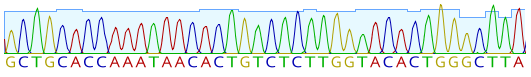
Gene sind für unsere körperlichen Merkmale verantwortlich. Sie bestehen aus DNA, die sich wiederum aus vier Basen zusammensetzt: Adenin, Cytosin, Guanin und Thymin. Dabei ist die Reihenfolge der Basen für die genetische Information entscheidend. Will man also ein Gen lesen, muss man dessen Sequenz so genau wie möglich bestimmen.
In den 1970er-Jahren entwickelte der britische Biochemiker Frederick Sanger eine Sequenzierungsmethode, anhand derer ihm 1977 die Sequenzierung eines kompletten Genoms gelang. Er hatte alle 5368 Nukleotide des Enterobakteriophagen PhiX174 entschlüsselt.
Im Herbst 1990 startete das Humangenomprojekt, ein internationales Forschungsprojekt, mit dem Ziel, das menschliche Genom vollständig zu sequenzieren – auch um Krankheiten wie etwa Erbkrankheiten diagnostizieren zu können, indem Fehler oder Unregelmäßigkeiten auf der DNA erkannt werden. Mehr als 1000 Wissenschaftlerinnen und Wissenschaftler aus 40 Ländern waren Teil des Projekts. Schließlich galt es, die Sequenz von rund drei Milliarden Basenpaaren der DNA zu finden. 13 Jahre später wurde der erfolgreiche Abschluss des Projekts verkündet. Das Verfahren war revolutionär, aber auf kleine Sequenzfragmente beschränkt. Zur Entschlüsselung großer Genome war immer noch ein enormer Arbeits- und Zeitaufwand notwendig.
Der Durchbruch kam erst mit dem Verfahren des Next-Generation Sequencing nach 2005. NGS, auch als high-throughput sequencing (HTS) bezeichnet, ist eine hochaktuelle und ständig verbesserte Technologie zur Sequenzierung von DNA und RNA. Mit diesem Hochdurchsatz-Verfahren können heutzutage riesige Mengen an Sequenzinformationen in sehr kurzer Zeit erfasst werden. Ein komplettes menschliches Genom wird so problemlos innerhalb weniger Tage entschlüsselt.
Während bei den vorherigen Methoden die verschiedenen Abschnitte der DNA einzeln sequenziert, untersucht und anschließend wieder zusammengefügt werden mussten, verlaufen die Prozesse beim NGS parallel. Mehrere hundert Millionen DNA-Abschnitte können gleichzeitig in einer Probe erfasst werden. Dabei basiert die Sequenzierung auf vier Schritten: der Fragmentierung, bei der DNA-Fragmente erzeugt werden, der Adapter-Bindung, bei der eine Art Bibliothek erstellt wird, der Amplifikation, bei der Cluster erstellt werden, und der Datenanalyse, bei der die enormen Datenmengen bioinformatisch aufbereitet und analysiert werden. NGS wird unter anderem in der klinischen Genetik, der Mikrobiologie, der Virologie und der Onkologie verwendet. Auch die Erfassung des sogenannten Mikrobioms ist nur mit Hilfe von NGS möglich geworden.
Das Projekt ZooSeq (https://zooseq.fli.de) will die Anwendung des Verfahrens im Hinblick auf das Ausfindigmachen von zoonotischen Erregern und deren Charakterisierung optimieren und die Anwendbarkeit in der Zoonoseforschung weiter verbessern.
Denn nach wie vor gibt es Materialien, bei denen eine Anpassung des Verfahrens bzw. der vorgeschalteten Extraktionsprotokolle nötig ist, wie etwa bei Formalin-fixiertem Material, also älterem Material, das mittels Formalin konserviert wird. Solche Proben sind von sehr großem Wert, da sie z.B. alte Pathogenvarianten enthalten können und damit einmalige Rückschlüsse auf die Evolution von Zoonoseerregern ermöglichen können.
Weiterhin sind besonders große Plasmide in Bakterien von Bedeutung, sie können aber aufgrund sich wiederholender Sequenzabschnitte nicht einfach sequenziert werden. Hier bedarf es einer Kombination verschiedener moderner Sequenzierungs-Methoden. Insbesondere die Generierung von sehr langen Fragmenten ist hierbei notwendig, was NGS-Methoden der neuesten Generation wie das nanopore sequencing ermöglichen.
Um letztlich die Optimierung der Verfahren effizient zu erreichen, wurden im Projekt fünf Arbeitspakete gegründet. Arbeitspaket 1 und Arbeitspaket 5 sind dabei übergreifende Pakete, die die übrigen drei umschließen und ineinandergreifen. Dabei umfasst das erste Arbeitspaket die Protokollsammlung. Es geht also den Fragen nach den jeweiligen Laborerfahrungen innerhalb des Netzwerkes nach und untersucht die Validierung der jeweiligen Methoden. Mit Arbeitspaket 5 liegt ein weiterer Schwerpunkt auf der Auswertung der Daten, also in der bioinformatischen Verarbeitung. In diesem Rahmen wird auch eine Kontaminationsdatenbank erstellt, in der identifizierte Kontaminationen von Sequenzdatensätzen gesammelt werden - was zukünftige Auswertungen solcher Datensätze erleichtert. Protokolle und Bioinformatik sollen schließlich allen zur Verfügung gestellt werden.
„Die Idee von ZooSeq ist eben auch, es mit den verbesserten, qualitätsgesicherten Methoden anderen Laboren zu ermöglichen, einfacher mit dieser Technik zu arbeiten“, sagt Prof. Dr. Martin Beer vom Friedrich-Loeffler-Institut, der das Projekt koordiniert.

Abb.1: Arbeitspakete des Vernetzungsprojektes ZooSeq
In Arbeitspaket 2 steht die präanalytische Optimierung im Fokus und damit das bereits erwähnte Formalin-fixierte Material. Außerdem steht die Abreicherung der Nukleinsäuren des Wirts im Vordergrund, da das Target (Pathogen) in komplexen Datensätzen meist nur zu einem kleinen Teil vorhanden ist. Die Targetanreicherung ist der Schwerpunkt in Arbeitspaket 3. Hierfür müssen die anzureichernden Targets bereits annähernd bekannt sein. Arbeitspaket 4 beschäftigt sich mit der Long-Read-Sequenzierung und somit mit der Entschlüsselung bakterieller Genome oder großer DNA-Viren, wie beispielsweise den Pockenviren.
Als erste Ergebnisse aus dem Projekt entstanden bereits validierte Protokolle im Hinblick auf Methoden zur Sequenzierung von Formalin-fixiertem Material. Die zunächst gesammelten Protokolle und der Vergleich untereinander ergaben, dass hier der Optimierungsbedarf besonders hoch ist.
Darüber hinaus wurde eine Methode entwickelt, die das Aufkonzentrieren von verschiedenen Sequenzabschnitten über sogenannte RNA-baits (Sonden) vornimmt. Ein ausgewählter Satz an RNA-Sonden, der gegen mehr als 50 relevante Viren aus verschiedensten Familien gerichtet ist, ermöglicht dabei die spezifische Anreicherung von epizootischen und zoonotischen Erregern. Diese NGS-basierte Diagnostikmethode ist universell und letztlich sensitiver als alle bisher genutzten spezifischen Verfahren. Gerade bei unklaren Krankheitsbildern kann diese Methode zeitaufwändige Verfahren ersetzen und damit zu einer beschleunigten Diagnose beitragen. Konkret wurde im Projekt neben unterschiedlichsten zoonotischen Erregern auch SARS-CoV-2 anhand dieser Methode sequenziert. Die Entdeckung, Überwachung und Kontrolle von neuen Mutationen eines Erregers ist nur durch kontinuierliche Sequenzierung möglich.
ZooSeq schafft damit einen Spagat zwischen der Entwicklung neuer Methoden und ihrer konkreten praxisnahen Anwendung, die von hoher Wichtigkeit ist.
„Wenn wir mit größeren Ausbrüchen, einer Epidemie oder gar Pandemie konfrontiert sind, wenn wir neue Erreger entdecken wollen, dann ist die Analyse mittels NGS das Mittel der Wahl“, so Beer.
Die aktuelle Pandemie hat uns eindringlich vor Augen geführt, dass diese Methoden zur Sequenzierung nicht nur notwendig sind, sondern auch für zahlreiche Labore zugänglich gemacht werden müssen.